йҷ•иҘҝзңҒжҰҶжһ—еёӮ2017-2018еӯҰе№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰдёүжЁЎиҖғиҜ•иҜ•еҚ·
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳиҖғ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
еҢ–еӯҰдёҺдәә们зҡ„з”ҹжҙ»е…ізі»еҜҶеҲҮпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҢ»з”Ёй…’зІҫж¶ҲжҜ’зҡ„еҺҹзҗҶжҳҜй…’зІҫе°Ҷз—…жҜ’ж°§еҢ–дәҶпјҢдҪҝе…¶дё§еӨұиҮҙз—…иғҪеҠӣ
B . вҖңз…Өж”№ж°”вҖқе’ҢвҖңз…Өж”№з”өвҖқзӯүжё…жҙҒиғҪжәҗж”№йҖ е·ҘзЁӢжңүеҲ©дәҺеҮҸе°‘йӣҫйңҫеӨ©ж°”
C . PM2.5жҳҜжҢҮеӨ§ж°”дёӯзӣҙеҫ„зӯүдәҺжҲ–е°ҸдәҺ2.5pmпјҲзҡ®зұіпјүзҡ„з»Ҷе°Ҹйў—зІ’зү©
D . дёәйҳІжӯўеҜҢи„ӮжңҲйҘјиў«ж°§еҢ–еҸҳиҙЁпјҢеёёеңЁеҢ…иЈ…иўӢдёӯж”ҫе…Ҙз”ҹзҹізҒ°жҲ–зЎ…иғ¶
|
|
| 2. еҚ•йҖүйўҳ | |
|
AгҖҒBжҳҜдёӨз§ҚйҮҚиҰҒзҡ„жңүжңәеҗҲжҲҗеҺҹж–ҷпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . AдёҺBжҳҜеҗҢзі»зү©
B . AдёҺBдёӯзӣёеҗҢзҡ„е®ҳиғҪеӣўжҳҜиӢҜзҺҜ
C . еңЁдёҖе®ҡжқЎд»¶дёӢпјҢA дёҺB еқҮиғҪеҸ‘з”ҹеҸ–д»ЈеҸҚеә”
D . AдёҺBйғҪиғҪдҪҝжәҙзҡ„еӣӣж°§еҢ–зўіжә¶ж¶ІиӨӘиүІ
|
|
| 3. еҚ•йҖүйўҳ | |
|
XгҖҒYгҖҒZгҖҒMжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢYзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜеҶ…еұӮз”өеӯҗж•°зҡ„3еҖҚпјҢYдёҺZ еҪўжҲҗзҡ„еҢ–еҗҲзү©Z2Y3дёӯпјҢе…ғзҙ иҙЁйҮҸжҜ”m(Y)пјҡm(Z)=8пјҡ9пјӣXеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°дёәMеҺҹеӯҗе’ҢZеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°зҡ„е’Ңзҡ„дёҖеҚҠгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . Xзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёҖе®ҡдёәејәй…ё
B . ж°”жҖҒж°ўеҢ–зү©зҡ„жІёзӮ№пјҡY<M
C . еҺҹеӯҗеҚҠеҫ„Z>M>X>Y
D . ZжҳҜең°еЈідёӯеҗ«йҮҸжңҖеӨҡзҡ„е…ғзҙ
|
|
| 4. еҚ•йҖүйўҳ | |
|
еҲ©з”Ёз”өеҜјзҺҮдј ж„ҹеҷЁеҸҜз»ҳеҲ¶з”өеҜјзҺҮжӣІзәҝеӣҫпјҢдёӢеӣҫдёәз”Ё0.1mol/LNaOHжә¶ж¶Іж»ҙе®ҡ10mL0.1mol/Lзӣҗй…ёиҝҮзЁӢдёӯзҡ„з”өеҜјзҺҮжӣІзәҝгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . з”өеҜјзҺҮдј ж„ҹеҷЁиғҪз”ЁдәҺеҲӨж–ӯй…ёзўұдёӯе’Ңж»ҙе®ҡзҡ„з»ҲзӮ№
B . aгҖҒbгҖҒc зӮ№зҡ„жә¶ж¶ІдёӯпјҢзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°ҸйЎәеәҸдёәa>b>c
C . dзӮ№жүҖзӨәжә¶ж¶ІдёӯеӯҳеңЁпјҡc(Cl-) +c(OH-) =c(H+) +c(Na+)
D . CзӮ№з”өеҜјзҺҮжңҖе°ҸжҳҜеӣ дёәжӯӨж—¶жә¶ж¶ІдёӯеҜјз”өеҫ®зІ’ж•°зӣ®жңҖе°‘
|
|
| 5. еҚ•йҖүйўҳ | |
|
дёӢеҲ—е…ідәҺз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣз§Қд»ӘеҷЁиЈ…зҪ®зҡ„з”Ёжі•пјҢдёҚеҗҲзҗҶзҡ„жҳҜпјҲ пјү
A . з”ІиЈ…зҪ®пјҡеҸҜз”ЁжқҘиҜҒжҳҺзЎ«зҡ„йқһйҮ‘еұһжҖ§жҜ”зЎ…ејә
B . д№ҷиЈ…зҪ®пјҡж©Ўзҡ®з®Ўзҡ„дҪңз”ЁжҳҜиғҪдҪҝж°ҙйЎәеҲ©жөҒдёӢ
C . дёҷиЈ…зҪ®пјҡз”ЁеӣҫзӨәзҡ„ж–№жі•иғҪжЈҖжҹҘжӯӨиЈ…зҪ®зҡ„ж°”еҜҶжҖ§
D . дёҒиЈ…зҪ®пјҡеҸҜеңЁз“¶дёӯе…ҲиЈ…е…Ҙжҹҗз§Қж¶ІдҪ“收йӣҶNOж°”дҪ“
|
|
| 6. еҚ•йҖүйўҳ | |
|
COеёёз”ЁдәҺе·ҘдёҡеҶ¶зӮјйҮ‘еұһпјҢеҰӮеӣҫжҳҜеңЁдёҚеҗҢжё©еәҰдёӢCOиҝҳеҺҹеӣӣз§ҚйҮ‘еұһж°§еҢ–зү©иҫҫе№іиЎЎеҗҺж°”дҪ“дёӯlg[c(CO)/c(CO2)]дёҺжё©еәҰ(t)зҡ„е…ізі»жӣІзәҝеӣҫгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . е·ҘдёҡдёҠеҸҜд»ҘйҖҡиҝҮеўһй«ҳеҸҚеә”иЈ…зҪ®жқҘ延й•ҝзҹҝзҹіе’ҢCOжҺҘи§Ұзҡ„ж—¶й—ҙпјҢеҮҸе°‘е°ҫж°”дёӯCOзҡ„еҗ«йҮҸ
B . COдёҚйҖӮе®ңз”ЁдәҺе·ҘдёҡеҶ¶зӮјйҮ‘еұһ铬(Cr)
C . е·ҘдёҡеҶ¶зӮјйҮ‘еұһй“ң(Cu)ж—¶иҫғй«ҳзҡ„жё©еәҰжңүеҲ©дәҺжҸҗй«ҳCOзҡ„еҲ©з”ЁзҺҮ
D . COиҝҳеҺҹPbO2зҡ„еҸҚеә”в–іH >0
|
|
| 7. еҚ•йҖүйўҳ | |
|
еҰӮеӣҫжүҖзӨәжҳҜеҮ з§Қеёёи§Ғзҡ„еҢ–еӯҰз”өжәҗзӨәж„ҸеӣҫпјҢжңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . дёҠиҝ°з”өжұ еҲҶеҲ«еұһдәҺдёҖж¬Ўз”өжұ гҖҒдәҢж¬Ўз”өжұ е’ҢзҮғж–ҷз”өжұ
B . е№Із”өжұ е·ҘдҪңж—¶пјҢH+еҗ‘й”Ңзӯ’移еҠЁ
C . й“…и“„з”өжұ е·ҘдҪңиҝҮзЁӢдёӯпјҢжҜҸйҖҡиҝҮ2 molз”өеӯҗпјҢиҙҹжһҒиҙЁйҮҸеҮҸиҪ»207g
D . ж°ўж°§зҮғж–ҷз”өжұ зҡ„жӯЈжһҒеҸҚеә”дёҖе®ҡжҳҜO2+4e-+2H2O=4OH-
|
|
| 8. з»јеҗҲйўҳ | |||||||||
|
ж°°еҢ–й’ еҢ–еӯҰејҸдёәNaCNпјҲCе…ғзҙ +2д»·пјҢNе…ғзҙ -3д»·пјүпјҢж°°еҢ–й’ жҳҜдёҖз§ҚзҷҪиүІз»“жҷ¶йў—зІ’пјҢеү§жҜ’пјҢжҳ“жә¶дәҺж°ҙпјҢж°ҙжә¶ж¶Іе‘ҲзўұжҖ§пјҢжҳ“ж°ҙи§Јз”ҹжҲҗж°°еҢ–ж°ўгҖӮ
|
|||||||||
| 9. е®һйӘҢжҺўз©¶йўҳ | |||||||||||||||||||
|
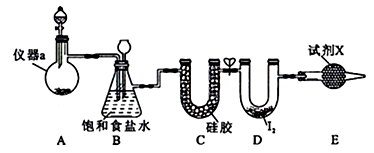
дёүж°ҜеҢ–зўҳ(ICl3)еңЁиҚҜзү©еҗҲжҲҗдёӯз”ЁйҖ”йқһеёёе№ҝжіӣпјҢе…¶зҶ”зӮ№дёә33в„ғпјҢжІёзӮ№дёә73в„ғгҖӮе®һйӘҢе®ӨеҸҜз”ЁеҰӮеӣҫиЈ…зҪ®еҲ¶еҸ–ICl3гҖӮ
|
|||||||||||||||||||
| 10. з»јеҗҲйўҳ | |
|
йҡҸзқҖжқҗж–ҷ科еӯҰзҡ„еҸ‘еұ•пјҢйҮ‘еұһй’’еҸҠе…¶еҢ–еҗҲзү©еҫ—еҲ°дәҶи¶ҠжқҘи¶Ҡе№ҝжіӣзҡ„еә”з”ЁпјҢ并被иӘүдёәвҖңеҗҲйҮ‘з»ҙз”ҹзҙ вҖқгҖӮе·ІзҹҘй’’зҡ„еҺҹеӯҗеәҸж•°дёә23пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
- йҮҚеәҶеёӮзјҷдә‘ж•ҷиӮІиҒ”зӣҹ2022еұҠй«ҳдёү第дёүж¬ЎиҜҠж–ӯжҖ§жЈҖжөӢеҢ–еӯҰиҜ•йўҳ
- еӣӣе·қзңҒжҲҗйғҪеёӮ2021е№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- жөҷжұҹзңҒжҷ®йҖҡй«ҳдёӯејәеҹәиҒ”зӣҹ2022еұҠй«ҳдёүдёҠеӯҰжңҹ12жңҲз»ҹжөӢеҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒеёёе·һеёӮж•ҷиӮІеӯҰдјҡ2021-2022еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯеӯҰдёҡж°ҙе№ізӣ‘жөӢеҢ–еӯҰиҜ•йўҳ
- е№ҝдёңзңҒе№ҝе·һеёӮеӨ©жІіеҢә2021е№ҙй«ҳиҖғеҢ–еӯҰдёүжЁЎиҜ•еҚ·
- жІіеҚ—зңҒйғ‘е·һеёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- жөҷжұҹзңҒзІҫиҜҡиҒ”зӣҹ2020-2021еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹеҢ–еӯҰ3жңҲжңҲиҖғиҜ•еҚ·
- еҢ—дә¬еёӮжңқйҳіеҢә2020-2021еӯҰе№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•йўҳ
- еұұдёңзңҒйқ’еІӣеёӮеҚіеўЁеҢә2020-2021еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- еӣӣе·қзңҒжҲҗйғҪеёӮи“үеҹҺеҗҚж ЎиҒ”зӣҹ2021-2022еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹиҒ”иҖғеҢ–еӯҰиҜ•йўҳ
- еҗүжһ—зңҒжҰҶж ‘еёӮ第дёҖй«ҳзә§дёӯеӯҰ2020-2021еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- еұұиҘҝзңҒеӨ§еҗҢеёӮ2022еұҠй«ҳдёүдёҠеӯҰжңҹеӯҰжғ…и°ғз ”жөӢиҜ•еҢ–еӯҰиҜ•йўҳ






 2SO3(g)гҖӮжҹҗжё©еәҰдёӢпјҢSO2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮ(a)дёҺдҪ“зі»жҖ»еҺӢејә(P)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮ
2SO3(g)гҖӮжҹҗжё©еәҰдёӢпјҢSO2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮ(a)дёҺдҪ“зі»жҖ»еҺӢејә(P)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮ



