高中化学人教版(2019)选择性必修1第三章实验活动2强酸与强碱的中和滴定
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 填空题 | |
|
某化学兴趣小组取一定量的双氧水,欲准确测定其中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释.用一定浓度的高锰酸钾标准溶液滴定,其反应的离子方程式为:2MnO4﹣+5H2O2+4H+═2Mn2++5O2↑+2H2O,滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中,滴定到达终点的现象是.
|
|
| 2. 填空题 | |||||||||||||||||||||
|
用25mL移液管量取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度,摇匀得到待测食醋溶液,用0.100 0mol•L﹣1NaOH标准溶液滴定,滴定过程中记录如下数据:
由以上数据可求得该市售食醋总酸含量的平均值为(g/100mL).(答案保留三位小数) |
|||||||||||||||||||||
| 3. 多选题 | |
|
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是( )
A . 酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B . 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C . 滴定时,没有逐出滴定管下口的气泡
D . 读数时,视线与滴定管内液体的凹液面最低处保持水平
|
|
| 4. 单选题 | |
|
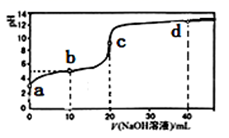
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
A . 酸性强弱顺序是HX>HY>HZ
B . 由图象可知,HY为弱酸,其电离常数数量级为10-6
C . pH=2的HZ溶液加水稀释10倍,pH为3
D . 加入20mLNaOH溶液时,只有HY溶液达到滴定终点
|
|
| 5. 实验探究题 | |||||||||
|
回答下列问题:
|
|||||||||
| 6. 单选题 | |
|
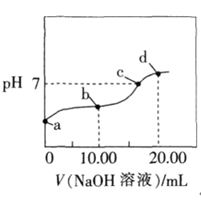
常温下,用0.1000mol·L-1的NaOH溶液滴定20.00mL未知浓度的某酸HX,滴定曲线如图所示。下列说法正确的是( )
A . 该酸的常温下的电离常数约为1×10-5
B . d点的溶液中:c(Na+)<c(X-)
C . 需用甲基橙作指示剂
D . b点溶液中:c(HX)>c(Na+)>c(H+)>c(OH-)
|
|
| 7. 实验探究题 | |||||||||||||||||||||||||||||
|
某学生欲用已知浓度的氢氧化钠标准溶液来滴定未知浓度的盐酸溶液,以酚酞试液为滴定指示剂。请填写下列空白:
|
|||||||||||||||||||||||||||||
| 8. 单选题 | |
|
次氯酸具有漂白和杀菌的作用。室温下,向20mL0.1mol·L-1次氯酸溶液中滴加同浓度的NaOH溶液,所得的滴定曲线如图所示。下列说法正确的是( )
A . c、d两点时,水的电离程度:d>c
B . d点溶液中:c(H+)=c(ClO-)-c(Na+)
C . 滴定时,由a点到c点,
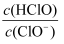 增大
D . a点时,溶液的pH=l 增大
D . a点时,溶液的pH=l
|
|
| 9. 单选题 | |
|
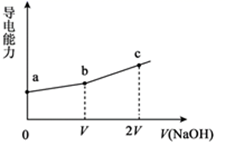
25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法错误的是( )
A . b点溶液的pH=7
B . 溶液的导电能力与离子种类和浓度有关
C . a→c过程中,n(CH3COO-)不断增大
D . c点的混合溶液中c(Na+)>c(OH-)>c(CH3COO-)
|
|
| 10. 单选题 | |
|
用NaOH标准溶液测定未知浓度的盐酸,下列实验操作不会引起误差的是( )
A . 用待测液润洗锥形瓶
B . 用蒸馏水洗净后的酸式滴定管直接量取待测液
C . 选用酚酞作指示剂,实验时不小心多加了两滴指示剂
D . 实验开始时碱式滴定管尖嘴部分无气泡,结束实验时有气泡
|
|