福建省莆田市2019年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活紧密相关,下列有关说法错误的是( )
A . 铝比铁活泼,铁制品比铝制品更耐腐蚀
B . 肥皂水显碱性,可用作蚂蚁叮咬处的清洗剂
C . 明矾净水是因为水解产生的氢氧化铝胶体具有吸附性
D . 制造国产C919大飞机用到的氮化硅陶瓷是新型无机非金属材料
|
|
| 2. 单选题 | |
|
设NA为阿伏加徳罗常数的值。下列有关叙述正确的是( )
A . 30g乙酸和葡萄糖混合物中的氢原子数为2NA
B . 2molSO2与3molO2反应生成的SO3分子数为2NA
C . 标准状况下,2.24LC2H6含有的共价键数为0.6NA
D . 常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
|
|
| 3. 单选题 | |
|
荧光棒的发光原理是H2O2氧化某草酸二酯(其结构简式如图所示)产生能量,传递给荧光物质发出荧光。下列有关该草酸二酯的说法错误的是( )
A . 分子中含氧官能团只有一种
B . 苯环上的一溴代物只有一种
C . 该有机物分子中的所有原子均共面
D . 可以发生取代反应和加成反应
|
|
| 4. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W2-和X+的电子层结构相同,X的原子半径是短周期主族元素原子中最大的,W与Y同族。下列说法一定正确的是( )
A . W、X形成的化合物只含有离子键
B . 离子半径:Y>Z>W
C . 还原性:W2->Y2-
D . 氧化物的水化物酸性:Y<Z
|
|
| 5. 单选题 | |
|
有关下图及实验的描述正确的是( )
A . 用图1装置蒸发FeCl3溶液制备无水FeCl3
B . 用图2装置精炼铝
C . 用图3装置证明浓硫酸具有脱水性和强氧化性
D . 用图4装置可比较氯、碳、硅三种元素的非金属性强弱
|
|
| 6. 单选题 | |
|
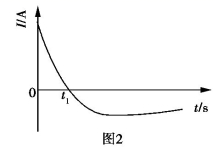
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
下列说法错误的是( )
A . 0~t1时,原电池的负极是Al片
B . 0~t1时,正极的电极反应式是
 +2H++e−=NO2↑+H2O
C . t1后,原电池的正、负极发生互变
D . t1后,正极上每得到0.3mol电子,则负极质量减少2.7g +2H++e−=NO2↑+H2O
C . t1后,原电池的正、负极发生互变
D . t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
|
|
| 7. 单选题 | |
|
常温下,几种难溶金属氢氧化物分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。下列说法正确的是( )
A . a点代表Fe(OH)3的饱和溶液
B . Ksp[Cu(OH)2]<Ksp[Fe(OH)2]
C . 在pH=7的溶液中,Cu2+、Mg2+、Fe2+能大量共存
D . 向各含0.1mol·L-1Cu2+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
|
|
| 8. 实验探究题 | |
|
天然脑砂含少量NH4Cl,《唐本草》记载脑砂入药可以散瘀消肿。某学习小组设计下列步骤制取NH4Cl,并进行天然脑砂含量的测定。请回答相关问题:
步骤Ⅰ用氨气与适量氯气反应制取NH4Cl
|
|
| 9. 综合题 | |
|
高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
|
|
| 10. 综合题 | |||||||||||||||||||
|
研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
|
|||||||||||||||||||
- 冲刺2021高考化学押题训练(十一)非金属及其化合物
- 河南省南阳市六校2021-2022学年高一下学期4月份期中联考化学试题
- 山东省泰安肥城市2020-2021学年高二上学期化学期中考试试卷
- 江苏省苏州八校联盟2021-2022学年高三上学期化学第一次月考试卷
- 浙江省宁波市六校2021-2022学年高二下学期期中联考化学试题
- 2021年高考理综化学真题试卷(全国甲卷)
- 冲刺2021高考化学押题训练(十二)常见有机物
- 黑龙江省大兴安岭呼玛县高级中学2020-2021学年高二上学期化学第三次月考试卷
- 山东省日照市五莲县2020-2021学年高二上学期化学期中考试试卷
- 北京市海淀区2021-2022学年高三上学期期中考试化学试题
- 河南省郑州市十校2021-2022学年高二下学期期中联考化学试题
- 河南省郑州市八所省示范高中2020-2021学年高一上学期化学期中考试试卷





 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O


 CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1
CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1



