福建省漳州市2018-2019学年高考化学二模考试试卷
福建省漳州市2018-2019学年高考化学二模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
铅霜(醋酸铅)是一种中药,具有解毒敛疮、坠痰镇惊之功效,其制备方法为:将醋酸放入磁皿,投入氧化铅,微温使之溶化,以三层细布趁热滤去渣滓,放冷,即得醋酸铅结晶;如需精制,可将结晶溶于同等量的沸汤,滴醋酸少许,过七层细布,清液放冷,即得纯净铅霜。制备过程中没有涉及的操作方法是( )
A . 萃取
B . 溶解
C . 过滤
D . 重结晶
|
|
| 2. 单选题 | |
|
螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )
A . 分子式为C8H16
B . 分子中所有碳原子共平面
C . 与2—甲基—3—庚烯互为同分异构体
D . 一氯代物有4种结构
|
|
| 3. 单选题 | |
|
用下列装置完成相应的实验能达到实验目的是( )
A .
 配制一定浓度的NaCl溶液
B . 配制一定浓度的NaCl溶液
B .  除去CO中的CO2
C . 除去CO中的CO2
C .  中和滴定
D . 中和滴定
D .  制取并检验SO2 制取并检验SO2
|
|
| 4. 单选题 | |
|
设阿伏加德罗常数的值为NA , 下列说法正确的是( )
A . 0.1mol氧气与2.3g金属钠充分反应,转移的电子数为0.4NA
B . 加热时, 6.4g铜粉与足量浓硫酸反应,转移的电子数为0.2NA
C . 将0.1mol乙烷和0.1molCL2混合光照,生成一氯乙烷的分子数为0.1NA
D . 0.2mol/L的NaAlO2溶液中AlO2-的数目小于0.2NA
|
|
| 5. 单选题 | |
|
短周期主族元素W、X,Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是( )
A . 最简单氢化物的稳定性:Z>W>Y
B . 原子半径:Y>X>W
C . X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝
D . Y的氧化物既能与碱反应,也能与酸反应,属于两性氧化物
|
|
| 6. 单选题 | |
|
锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e−=4Cl−+S+SO2↑,该电池工作时,下列说法错误的是( )
A . 锂电极区发生的电极反应:Li-e−=Li+
B . 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C . 锂电极上的电势比碳电极上的低
D . 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
|
|
| 7. 单选题 | |
|
常温下,用0.01mol•L-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )
A . Ka(HCN)的数量级为10-8
B . 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C . 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D . 在标示的四种情况中,水的电离程度最大的是②
|
|
| 8. 综合题 | |||||||||||||||||||
|
工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:
已知:①菱锰矿的主要成分是MnCO3 , 其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
③焙烧过程中主要反应为MnCO3+2NH4Cl
|
|||||||||||||||||||
| 9. 综合题 | ||||||||||||||||||||||||||||||
|
“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
|
||||||||||||||||||||||||||||||
| 10. 综合题 | |
|
奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为 请回答下列问题:
|
|
高中化学 试卷推荐
- 辽宁省朝阳市2021-2022学年高一下学期开学考试化学试题
- 安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题
- 安徽省芜湖市安庆市2020-2021学年高一上学期期末教学质量监控化学试题
- 广东省深圳市2020-2021学年高一下学期期末调研考试化学试题
- 备考2021年高考化学二轮专题 第9讲 物质的结构与性质
- 陕西省宝鸡市金台区2021-2022学年高三第一次模拟检测化学试题
- 浙江之江教育评价2020-2021学年高一下学期化学期中考试试卷
- 内蒙古自治区乌兰察布市四子王旗第一中学2020-2021学年高三上学期化学期中考试试卷
- 备考2021年高考化学二轮专题 第6讲 化学反应速率和化学平衡
- 四川省成都市郫都区2020-2021学年高二下学期化学期中考试试卷
- 河南省许昌市2020-2021学年高二下学期化学期末考试试卷
- 北京市朝阳区2021-2022学年高一上学期期末考试化学试题
最近更新



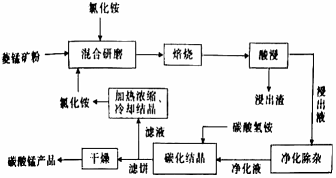
 MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O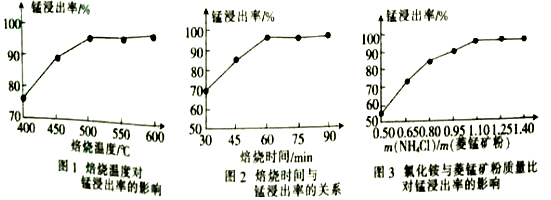
 CO2(g)+H2(g),△H1=-41.0kJ•mol-1 , ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1 , ③CH3OCH2(g)+H2O(g)
CO2(g)+H2(g),△H1=-41.0kJ•mol-1 , ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1 , ③CH3OCH2(g)+H2O(g) 
 的合成路线流程图(无机试剂任选),合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选),合成路线流程图示例如下:CH3CH2Br  CH3CH2OH
CH3CH2OH 


