2016年高考理综真题试卷(化学部分)(新课标Ⅰ卷)
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-04-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活密切相关,下列有关说法错误的是( )
A . 用灼烧的方法可以区分蚕丝和人造纤维
B . 食用油反复加热会产生稠环芳香烃等有害物质
C . 加热能杀死流感病毒是因为蛋白质受热变性
D . 医用消毒酒精中乙醇的浓度为95%
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
A . 14g乙烯和丙烯混合气体中的氢原子数为2NA
B . 1mol N2与4mol H2反应生成的NH3分子数为2NA
C . 1mol Fe溶于过量硝酸,电子转移数为2NA
D . 标准状况下,2.24L CCl4含有的共价键数为0.4NA
|
|
| 3. 单选题 | |
|
下列关于有机化合物的说法正确的是( )
A . 2﹣甲基丁烷也称异丁烷
B . 由乙烯生成乙醇属于加成反应
C . C4H9Cl有3种同分异构体
D . 油脂和蛋白质都属于高分子化合物
|
|
| 4. 单选题 | |
|
下列实验操作能达到实验目的是( )
A . 用长颈漏斗分离出乙酸与乙醇反应的产物
B . 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C . 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D . 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
|
|
| 5. 单选题 | |
|
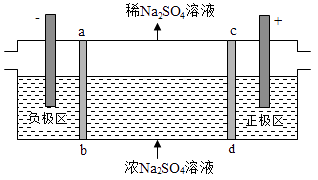
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
A . 通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B . 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C . 负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D . 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
|
|
| 6. 单选题 | |
|
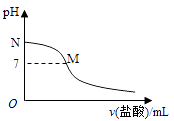
298K时,在20.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L﹣1氨水的电离度为1.32%,下列有关叙述正确的是( )
A . 该滴定过程应该选择酚酞作为指示剂
B . M点对应的盐酸体积为20.0mL
C . M点处的溶液中c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D . N点处的溶液中pH<12
|
|
| 7. 推断题 | |
|
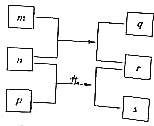
短周期元素W,X,Y,Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
A . 原子半径的大小W<X<Y
B . 元素的非金属性Z>X>Y
C . Y的氢化物常温常压下为液态
D . X的最高价氧化物的水化物为强酸
|
|
| 8. 实验探究题 | |||||||||||||
|
氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NO2反应进行了探究.回答下列问题:
|
|||||||||||||
| 9. 综合题 | |
|
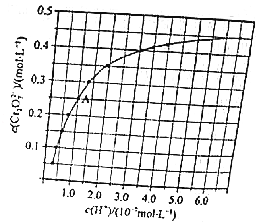
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
|
|
| 10. 实验探究题 | |
|
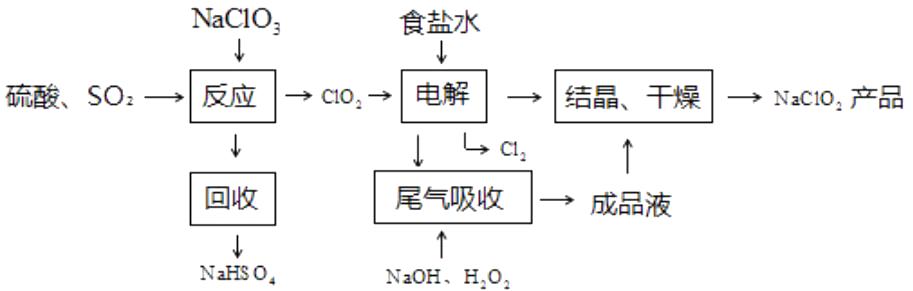
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
|
|
- 2016-2017学年广西柳州市铁路一中高二上学期期末化学试卷
- 山东省临沂市2017-2018学年高三上学期化学期中考试试卷
- 上海市长宁区2020年高考化学二模试卷
- 云南省昆明市2017-2018学年高考理综-化学3月模拟考试试卷
- 广东省云浮市2019-2020学年高一下学期化学期末考试试卷
- 人教版化学高一必修一第四章第一节无机非金属材料的主角--硅同步练习
- 人教版化学高二选修1第三章第四节塑料、纤维和橡胶同步练习
- 2016-2017学年天津市芦台一中等六校联考高二上学期期中化学试卷
- 天津市武清区2018-2019学年高三上学期化学期中考试试卷
- 人教版化学高二选修5第四章第一节油脂同步练习
- 四川省达州市2016-2017学年高二上学期化学期末考试试卷
- 安徽省天长市铜城中学2018-2019学年高一下学期化学期末考试试卷