2016年湖南省衡阳市高考化学模拟试卷
2016年湖南省衡阳市高考化学模拟试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
2015年国际十大环境新闻之一是“《巴黎协定》”;降低碳排放,明确全球升温控制在2℃内的目标,下列有关二氧化碳的说法不正确的是( )
A . 二氧化碳是一种弱电解质
B . 金属钠着火不能用液态二氧化碳灭火
C . 二氧化碳和水经“人工树叶”合成燃油,可实现由太阳能转变为化学能
D . 用二氧化碳合成可降解的聚碳酸酯塑料,有利于遏制白色污染
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A . 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA
B . 1molNa2O2中的离子总数为4NA
C . 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA
D . 1mol苯分子中所含的碳碳双键数为3NA
|
|
| 3. 单选题 | |
|
W,X,Y,Z为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和为22,W与Y同主族,W2﹣具有与氖原子相同的电子层结构.下列说法正确的是( )
A . 简单离子半径:Y>X>W
B . 单质的氧化性:W>Y>Z
C . 化合物ZW2具有强还原性
D . 化合物Y2Z2中只含共价键
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列实验操作对应的实验现象和结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
一种锌/铁液流贮能电池结构如图所示.下列说法正确的是( )

A . 放电时,Na+从中间室进入负极室
B . 充电时,Cl﹣从阳极室进入中间室
C . 放电时,负极的电极反应为Zn+4OH﹣﹣2e﹣=Zn(OH)42﹣
D . 充电时,阳极的电极反应为Fe3++e﹣=Fe2+
|
|
| 6. 单选题 | |
|
现有四种有机物①C3H7Cl②C3H8O③C3H6O④C3H6O2 , 下列有关说法正确的是( )
A . ①、②、③、④均只有两种结构
B . ①的同分异构体数目与④的相同
C . ③一定是丙醛
D . 若②与④能发生酯化反应,则生成的酯最多有2种
|
|
| 7. 单选题 | |
|
常温下,将浓度均为0.10mol.L﹣1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg
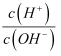 ]随lg ]随lg  的变化如图所示,下列叙述错误的是( ) 的变化如图所示,下列叙述错误的是( )
A . HX的酸性强于HY的酸性
B . a点的c(Y﹣)与b点的c(X﹣)相等
C . 水的电离程度:a点小于c点
D . 若两溶液同时升高温度,则c(Y﹣)和c(X﹣)均增大
|
|
| 8. 实验探究题 | |
|
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2 . 请从图中选择适当的装置(部分装置可以重复)进行实验.
|
|
| 9. 实验探究题 | |||||||||||||
|
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.某兴趣小组以黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
|
|||||||||||||
| 10. 综合题 | |
|
氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:
MgH2(s)⇌Mg(s)+H2(g)△H1 2Mg(s)+O2(g)⇌2MgO(s)△H2 2MgO(s)+2SO2(g)⇌2MgSO4(s)△H3
|
|
高中化学 试卷推荐
- 2016-2017学年广东省东莞市四校联考高一下学期期中化学试卷
- 人教版化学高二选修3第二章第二节分子的立体结构同步练习
- 2016-2017学年山东省菏泽市高二上学期期中化学试卷(b)
- 天津市和平区2017-2018学年高一上学期化学期末考试试卷
- 四川省南江中学高二11月月考化学试卷
- 2016-2017学年江苏省徐州市邳州市运河中学高三上学期开学化学试卷
- 贵州省遵义市2019-2020学年高二下学期化学期末考试试卷
- 2015-2016学年江西省宜春市高安二中高一上学期期中化学试卷(奥赛班)
- 浙江省金衢六校联考2015-2016学年高一上学期化学期中考试试卷
- 2017年湖南省郴州市高考化学一模试卷
- 人教版高中化学选修四化学反应原理综合
- 2015-2016学年甘肃省天水三中高二下学期第一次月考化学试卷
最近更新



 Al2O3+3H2O、.
Al2O3+3H2O、.




