高中化学人教版(2019)选择性必修1第一章第二节反应热的计算
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 填空题 | |
|
|
| 2. 填空题 | |
|
碳的化合物在生产、生活中有着重要的作用。
已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1 H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1 CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1 则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1 |
|
| 3. 综合题 | |
|
按要求回答下列问题。
|
|
| 4. 单选题 | |
|
我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+ 反应②:C(s)+H2O(g)=CO(g)+H2(g) △H2 反应③:CO(g)+2H2(g)=CH3OH(g) △H3=-90.1 kJ·mol-1 反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4 , 能量变化如下图所示 反应⑤:3CH3OH(g) 下列说法正确的是
A . 反应③使用催化剂,△H3减小
B . △H1-△H2>0
C . 反应④中正反应的活化能大于逆反应的活化能
D . 3CO(g)+6H2(g)
 CH3CH=CH2(g)+3H2O(g) △H=-301.3 kJ·mol-1 CH3CH=CH2(g)+3H2O(g) △H=-301.3 kJ·mol-1
|
|
| 5. 单选题 | |
|
通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法错误的是( )
①C(s)+H2O(g)=CO(g)+H2(g) ②CO2(g)+H2(g)=CO(g)+H2O(g) ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ④2CH3OH(g)=CH3OCH3(g)+H2O(g)
A . 反应①、②为反应③提供原料气
B . 反应③也是CO2资源化利用的方法之一
C . 反应CH3OH(g)=
 CH3OCH3(g)+ CH3OCH3(g)+  H2O(l)的 H2O(l)的  H= H=  kJ kJ 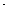 mol−1
D . 反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 mol−1
D . 反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的  H=(-2b+2c+d)kJ H=(-2b+2c+d)kJ 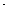 mol−1 mol−1
|
|
| 6. 单选题 | |
|
关于下列 ΔH的判断错误的是( )
H2S(g)+ H2S(g)+ 2H2S(g)+SO2(g)= 2H2S(g)+SO2(g)= 8S(g)=S8(g) ΔH5
A . ΔH1<0 ΔH5<0
B . ΔH1<ΔH2
C . ΔH5=
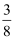 (ΔH1+ΔH4-3ΔH2)
D . ΔH3<ΔH4 (ΔH1+ΔH4-3ΔH2)
D . ΔH3<ΔH4
|
|
| 7. 填空题 | |
|
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现已知火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,反应生成N2(g)和气态的水,据下列的2个热化学反应方程式:
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol 试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式: |
|
| 8. 多选题 | |
|
已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示,下列说法正确的是( )
A . ∆H1<0,∆H2>0
B . -∆H5+∆H1+∆H2+∆H3+∆H4+∆H6=0
C . ∆H3<0,∆H4<0
D . 氧化锂的晶格能=∆H6
|
|
| 9. 实验探究题 | |
|
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、丙烷、乙硼烷等都是很有发展前景的新能源。
|
|
| 10. 单选题 | |
|
下列对化学反应的认识错误的是( )
A . 化学反应过程中,一定有化学键的断裂和形成,并遵循质量守恒和能量守恒
B . 决定反应速率的主要因素是反应物的性质
C . 可逆反应达到化学平衡状态时,正、逆反应的速率一定相等
D . 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
|
|
- 2021高考真题汇编-化学反应中的能量变化
- 上海市虹口区2021年高考化学二模试卷
- 吉林省永吉县第四中学2021-2022学年高一上学期化学9月月考试卷
- 辽宁省大连市2022届高三第一次模拟考试化学试题
- 四川省遂宁市2021-2022学年高三下学期三诊化学试题
- 陕西省渭南市大荔县2020-2021学年高二上学期期末考试化学试题
- 重庆市2021年高考化学一模试卷
- 陕西省西安市蓝田县2020-2021学年高二下学期期末质量监测化学试题
- 四川省内江市2020-2021学年高二上学期期末考试化学试题
- 陕西省西安市阎良区2021-2022学年高一上学期期末考试化学试题
- 陕西省咸阳市武功县2020-2021学年高二下学期化学期中考试试卷
- 江苏省如皋市2020-2021学年高一上学期化学期中考试试卷
 ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。

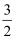 O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1 
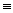 CH(g)+H2(g)△H=+156.6kJ/mol
CH(g)+H2(g)△H=+156.6kJ/mol 



