2021高考真题汇编-化学反应中的能量变化
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )
A . NH3中H元素被氧化
B . NO2在反应过程中失去电子
C . 还原剂与氧化剂的物质的量之比为3:4
D . 氧化产物与还原产物的质量之比为4:3
|
|
| 2. 单选题 | ||||||||||
|
已知共价键的键能与热化学方程式信息如下表:
则2O(g)=O2(g)的ΔH为( )
A . 428 kJ·mol-1
B . -428 kJ·mol-1
C . 498 kJ·mol-1
D . -498 kJ·mol-1
|
||||||||||
| 3. 单选题 | |
|
镍镉电池是二次电池,其工作原理示意图如下(L 为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
下列说法错误的是( )
A . 断开K2、合上K1 , 镍镉电池能量转化形式:化学能→电能
B . 断开K1、合上K2 , 电极A为阴极,发生还原反应
C . 电极B发生氧化反应过程中,溶液中KOH浓度不变
D . 镍镉二次电池的总反应式:Cd+ 2NiOOH+2H2O
 Cd(OH)2+2Ni(OH)2 Cd(OH)2+2Ni(OH)2
|
|
| 4. 综合题 | |
|
玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH (x-1)S+K2S S+ K2SO3 请计算:
|
|
| 5. 综合题 | |
|
“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
|
|
| 6. 综合题 | |
|
某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 2H++2CrO 相关物质的溶解度随温度变化如下图。 请回答:
|
|
| 7. 单选题 | |
|
沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排故并 降低冷却效率。为解决这一问题,通常在管道口设置一对情性电极(如图所示),通入一定的电流。
下列叙述错误的是( )
A . 阳极发生将海水中的
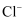 氧化生成 氧化生成 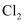 的反应
B . 管道中可以生成氧化灭杀附着生物的NaClO
C . 阴极生成的 的反应
B . 管道中可以生成氧化灭杀附着生物的NaClO
C . 阴极生成的  应及时通风稀释安全地排入大气
D . 阳极表面形成的Mg 应及时通风稀释安全地排入大气
D . 阳极表面形成的Mg  等积垢需要定期清理 等积垢需要定期清理
|
|
| 8. 综合题 | ||||||||||||||||
|
磁选后的炼铁高钛炉渣,主要成分有
 、 、 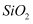 、 、  、MgO、CaO以及少量的 、MgO、CaO以及少量的  ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。 ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
|
||||||||||||||||
| 9. 综合题 | |
|
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。 II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。 III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。 IV.离心分离,稀盐酸洗涤沉淀。 V.蒸馏水洗涤沉淀。 VI.冷冻干燥,得到土黄色的氧化石墨烯。 回答下列问题:
|
|
| 10. 综合题 | |
|
一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
|
|
- 北京市东城区2017-2018学年高考理综-化学二模考试试卷
- 辽宁省大连市2019-2020学年高二下学期化学期末考试试卷
- 2015-2016学年河北省秦皇岛市卢龙县高一下学期期中化学试卷
- 2016-2017学年北京市海淀区高一下学期期中化学试卷
- 2016-2017学年山东省淄博市淄川一中高一上学期期中化学试卷
- 河北省保定市定兴中学2019-2020学年高二下学期化学4月线上月考试卷
- 吉林省长春市2020年高考理综-化学二模试卷
- 2015-2016学年江西省上饶市广丰县一中高一上学期第二次月考化学试卷(星)
- 2016-2017学年江苏省连云港市锦屏高中高一上学期期中化学试卷
- 北京市昌平区2016-2017学年高三上学期化学期末考试试卷
- 吉林省松原市前郭尔罗斯蒙古族自治县蒙古族中学2019-2020学年高二下学期化学线上月考试卷
- 2015-2016学年陕西省西安市交通大学二附中高二上学期第二次月考化学试卷

 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
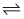 Cr2O
Cr2O 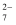 +H2O
+H2O






 的化学方程式。
的化学方程式。

 水解析出
水解析出  沉淀,该反应的离子方程式是。
沉淀,该反应的离子方程式是。

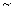
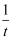 和lgKP2
和lgKP2 



