安徽省合肥市2018-2019学年高考化学三模考试试卷
安徽省合肥市2018-2019学年高考化学三模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化工生产与人类进步紧密相联。下列有关说法错误的是( )
A . 空气吹出法提取海水中溴通常使用SO2作还原剂
B . 侯氏制碱法工艺流程中利用了物质溶解度的差异
C . 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D . 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数值。下列有关叙述错误的是( )
A . 常温常压下,1 mol氦气中含有的质子数为2NA
B . l0g46%乙醇水溶液中所含氧原子数为0.4NA
C . 1 L1mol/LNa2CO3溶液中,阴离子总数小于NA
D . 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
|
|
| 3. 单选题 | |
|
环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是( )
A . n分子中所有原子都在同一个平面上
B . n和:CBr2生成p的反应属于加成反应
C . p分子中极性键和非极性键数目之比为2:9
D . m分子同分异构体中属于芳香族化合物的共有四种
|
|
| 4. 单选题 | |
|
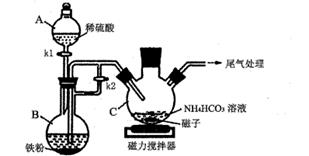
下列有关实验能达到相应实验目的的是( )
A . 实验①用于实验室制备氯气
B . 实验②用于制备干燥的氨气
C . 实验③用于石油分馏制备汽油
D . 实验④用于制备乙酸乙酯
|
|
| 5. 单选题 | |
|
如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( )
A . X、Y、W三种元素最低价氢化物的沸点依次升高
B . Z、X、W三种元素氧化物对应水化物的酸性依次增强
C . 由X、W和氢三种元素形成的化合物中只含共价键
D . X、Z形成的二元化合物是一种新型无机非金属材料
|
|
| 6. 单选题 | |
|
下列有关电化学原理及应用的相关说法正确的是( )
A . 电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能
B . 电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒
C . 工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同
D . 电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极
|
|
| 7. 单选题 | |
|
25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法错误的是( )
A . a点溶液中:c(H+)=6.0
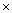 10-3mol 10-3mol  L-1
B . b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C . c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D . d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH) L-1
B . b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C . c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D . d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
|
|
| 8. 实验探究题 | |
|
乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
|
|
| 9. 实验探究题 | |
|
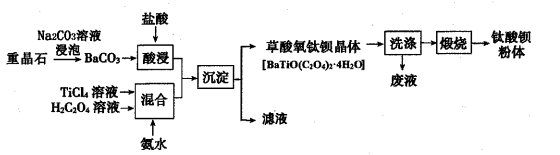
某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
回答下列问题:
|
|
| 10. 综合题 | |
|
一定条件下,1molCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。
回答下列问题:
|
|
高中化学 试卷推荐
- 2015年四川省成都市崇州市崇庆中学高考化学“一诊”模拟试卷(四)
- 2015年吉林省长春市高考化学模拟试卷(四)
- 河南省平顶山市、许昌市、汝州2017-2018学年高二上学期化学期中考试试卷
- 宁夏回族自治区吴忠市吴忠中学2018-2019学年高二化学期中考试模拟试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 湖南师大附中2015-2016学年高二下学期化学入学考试试卷
- 高中化学人教版(2019)选择性必修1第二章第二节化学平衡
- 江西省南昌市2017-2018学年高考理综-化学三模考试试卷
- 安徽省马鞍山市2019-2020学年高一下学期化学期末考试试卷
- 2016年黑龙江省大庆市高考化学一模试卷
- 2015-2016学年河南省洛阳市孟津一中高二上学期期末化学试卷
- 2015-2016学年广西桂林市临桂中学高二下学期期中化学试卷
最近更新





 =
=
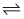 CH3OH(g)
CH3OH(g) 




