人教(新课标)高中化学一轮复习:专题10化学反应速率与化学平衡
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 多选题 | |
|
苯与Br2的催化反应历程如图所示。下列说法正确的是( )
A .
|
|
| 2. 多选题 | |
|
已知反应
  。当反应器中按 。当反应器中按  投料后,在不同温度下,反应达到平衡时,得到混合物中 投料后,在不同温度下,反应达到平衡时,得到混合物中  的物质的量分数随压强的变化曲线 的物质的量分数随压强的变化曲线  、 、  、 、  如图所示。下列说法正确的是( ) 如图所示。下列说法正确的是( )
A . 若反应器中充入
 和 和  ,则反应达平衡时将释放9.22 kJ热量
B . 从M到Q,平衡向左移动
C . 图中M,N,Q点平衡常数K的大小关系为 ,则反应达平衡时将释放9.22 kJ热量
B . 从M到Q,平衡向左移动
C . 图中M,N,Q点平衡常数K的大小关系为  D . M,N,Q达到平衡所需时间关系为
D . M,N,Q达到平衡所需时间关系为 
|
|
| 3. 多选题 | |
|
在一恒容密闭容器中发生反应:
 。起始时, 。起始时,  , ,  , ,  。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是( ) 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是( )
A .
 B .
B .  C .
C .  D .
D . 
|
|
| 4. 多选题 | |
|
一定条件下,等物质的量的
 和 和  在一恒容密闭容器中发生反应: 在一恒容密闭容器中发生反应:  。如图所示,曲线a表示该反应在 。如图所示,曲线a表示该反应在 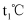 时X的物质的量浓度随时间的变化,曲线b表示该反应在某一反应条件改变时X的物质的量浓度随时间的变化。下列说法错误的是( ) 时X的物质的量浓度随时间的变化,曲线b表示该反应在某一反应条件改变时X的物质的量浓度随时间的变化。下列说法错误的是( )
A .
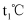 时,x的平衡转化率为 时,x的平衡转化率为  B .
B . 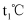 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大
C . 若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大
C . 若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数  D . 若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和
D . 若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和
|
|
| 5. 多选题 | |
|
向1L密闭容器中充入足量的焦炭和1molSO2(g)发生反应:
 。测得SO2的生成速率与S2(g)的生成速率随温度变化如图所示。下列说法正确的是( ) 。测得SO2的生成速率与S2(g)的生成速率随温度变化如图所示。下列说法正确的是( )
A . 正反应的活化能小于逆反应的活化能
B . 达到平衡后再加热,平衡向正反应方向移动
C . A,B,C,D四点对应状态下,达到平衡状态的是B、D
D . 达到平衡后缩小容器容积,重新达到平衡后,SO2的平衡转化率增大
|
|
| 6. 填空题 | |
|
在 2020 年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标,因此利用煤炭或CO 2 合成其它高价值化学品的工业生产显得更加重要。
|
|
| 7. 填空题 | |
|
硫酰氯
 和亚硫酰氯 和亚硫酰氯  均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂. 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂. 已知:Ⅰ. II.
|
|
| 8. 实验探究题 | |
|
某小组研究化学平衡的移动
|
|
| 9. 单选题 | |||||||||||||||||||||
|
下列对化学反应预测正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 10. 单选题 | |
|
常压下羰基化法精炼镍的原理为Ni(s)+4CO(g)
 Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4; Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。 下列判断正确的是( )
A . 增加c(CO),平衡向正向移动,反应的平衡常数增大
B . 第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C . 第二阶段,Ni(CO)4分解率较低
D . 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
|
|
- 湖南省娄底市娄星区2020-2021学年高二下学期化学期中考试试卷
- 黑龙江省大庆市2021-2022学年高三上学期第一次教学质量检测化学试题
- 广东省梅州市梅江区梅州中学2021-2022学年高二上学期化学第一次月考试卷
- 浙江省宁波市奉化区2020-2021学年高二下学期化学期末考试试卷
- 2021年高考化学真题试卷(山东卷)
- 河南省郑州市2021年高考化学三模试卷
- 江西省新建一中2020-2021学年高二下学期化学开学考试试卷
- 湖北省石首市2021-2022学年高一下学期期中考试化学试
- 四川省岳池县2021-2022学年高二上学期期中考试化学试题
- 河南省新乡市2021-2022学年高一下学期期中考试化学试题
- 浙江省台州市九校联盟2021-2022学年高一下学期期中考试化学试题
- 浙江省湖州市2020-2021学年高二上学期化学期末考试试卷




 ΔH2=-571kJ mol−1
ΔH2=-571kJ mol−1 CO2(g)+2H2(g)的 ΔH = 。
CO2(g)+2H2(g)的 ΔH = 。


 和
和  ,发生反应:
,发生反应:  ,下列示意图能说明
,下列示意图能说明 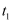 时刻反应达到平衡状态的是(填序号).
时刻反应达到平衡状态的是(填序号). 
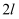 恒容密闭容器中加入
恒容密闭容器中加入  ,经
,经  反应Ⅰ达到平衡.测得
反应Ⅰ达到平衡.测得  ,则平衡时
,则平衡时  的转化率
的转化率  .保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时
.保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时  ,则
,则 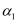 (填“>”“<”“=”)
(填“>”“<”“=”)

 +H2O=2Fe2++SO
+H2O=2Fe2++SO  +2H+ , 则证明iii中平衡逆向移动的准确实验现象描述是。
+2H+ , 则证明iii中平衡逆向移动的准确实验现象描述是。



