四川省岳池县2021-2022学年高二上学期期中考试化学试题
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
反应A+B→C分两步进行:反应①A+B→X,反应②X→C。反应过程中能量变化如图,下列说法正确的是( )
A . 该反应为放热反应,△H=a-d
B . 催化剂通过降低化学反应的焓变加快化学反应速率
C . 升高温度,a、b、c、d的数值均会发生改变
D . 该反应速率的快慢主要由反应②决定
|
|
| 2. 单选题 | |
|
10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心点火升空。长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法错误的是( )
A . 煤油和液氢都是可再生能源
B . 火箭燃料燃烧时,化学能转化为热能
C . 运载火箭主体结构件框所用高精尖铝合金材料具有质量轻、强度高等优点
D . 液氢属于纯净物,煤油属于混合物
|
|
| 3. 单选题 | |
|
NA表示阿伏加德罗常数,下列说法错误的是( )
A . 25℃时,1LpH=13的Ba(OH)2和BaCl2混合溶液中含有的OH-数目为0.1NA
B . 1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C . 100mL0.1mol·L-1的NaOH水溶液中含有的氧原子数为0.01NA
D . 月壤中含有3He,6g3He含有的中子数为2NA
|
|
| 4. 单选题 | |
|
下列图示装置不能达到实验目的的是( )
A . 图1:验证温度对化学平衡的影响
B . 图2:测定锌与稀硫酸的反应速率
C . 图3:验证FeCl3溶液对H2O2分解有催化作用
D . 图4:研究浓度对反应速率的影响
|
|
| 5. 单选题 | |
|
某温度下,将等物质的量的气体A、B混合于1L的密闭容器中,发生如下反应:A(g)+3B(g)⇌2C(g)+xD(g)。经2min后测得C的浓度为0.5mol/L,B的物质的量分数为25%,以D表示2min内的平均反应速率v(D)=0.25mol/L·min),下列说法正确的是( )
A . 2min时,v(A)=0.125mol/L·min
B . 2min时,B的物质的量为0.75mol
C . x=1
D . 反应前后容器内气体的压强之比为1:2
|
|
| 6. 单选题 | |
|
如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断错误的是( )
A . T>25
B . 两条曲线上任意点均有c(H+)×c(OH-)=Kw
C . a点和d点pH=7,溶液都呈中性
D . 25℃时,将CO2通入NaOH溶液中,可由e点变成b点
|
|
| 7. 单选题 | |
|
已知:M(g)+2N(g)⇌3P(g) ΔH<0,向一恒温恒容的密闭容器中充入1molM和3molN发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,化学反应速率随时间的变化如图所示。下列说法正确的是( )
A . 容器内压强不变,表明反应达到平衡
B . t2时改变的条件:向容器中加入P
C . 平衡时M的体积分数φ:φ(II)<φ(I)
D . 平衡常数K:K(II)<K(I)
|
|
| 8. 综合题 | |||||||||
|
根据所学内容,回答下列问题:
|
|||||||||
| 9. 综合题 | |
|
我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一,可利用CH4与CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,发生反应:CO(g)+2H2(g)⇌ CH3OH(g) ΔH=-99kJ·mol-1。
|
|
| 10. 实验探究题 | |||||||||||||||||||
|
实验室中有一未知浓度的稀盐酸,某学生测定稀盐酸的浓度并利用此盐酸进行中和热的测定实验。请完成下列填空:
|
|||||||||||||||||||
- 2016-2017学年山东省临沂市高一上学期期中化学试卷
- 2015-2016学年陕西省汉中中学高一上学期期中化学试卷
- 2015-2016学年广东省肇庆市高一下学期期末化学试卷
- 浙江省金华市曙光学校2019-2020学年高一下学期化学开学考试卷
- 专题20:原电池
- 广东省深圳市2020年高考理综-化学一模试卷
- 2016年天津市和平区高考化学一模试卷
- 2017-2018学年高中化学人教版 选修五 第一章 第一节 有机化合物的分类
- 湖北省黄冈市2019-2020学年高二下学期化学期末考试试卷
- 人教(新课标)高中化学一轮复习:专题1化学计量在实验中的运用
- 2015-2016学年吉林省白城市通榆一中高二下学期期中化学试卷
- 备考2018年高考化学二轮专题复习 专题九:化学反应速率与化学平衡




 经过两步反应被氧化成
经过两步反应被氧化成  。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: 
 O2(g)=
O2(g)= 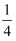 P4O10(s) ΔH2=-738.5kJ·mol-1
P4O10(s) ΔH2=-738.5kJ·mol-1 的关系如图所示。
的关系如图所示。