备考2019年高考化学二轮专题 14 综合实验探究与设计
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 实验探究题 | |
|
实验室常用乙醇与浓硫酸来制取乙烯,反应装置如下图A所示,发生反应为CH3CH2OH
 CH2=CH2↑+H2O CH2=CH2↑+H2O
请回答下列问题:
|
|
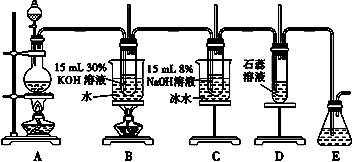
| 2. 单选题 | |||||||||||||||||||||
|
向四支试管中分别加入少量不同的无色溶液进行如下操作,现象、结论正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 3. 单选题 | |||||||||||||||||||||
|
检验下列物质的试剂、现象都正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 4. 实验探究题 | |
|
实验题
某研究性学习小组设计了如图装置制取和验证SO2的性质。 请回答:
|
|
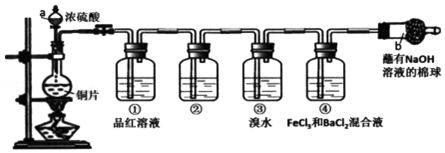
| 5. 实验探究题 | |||||||||||||
|
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
|
|||||||||||||
| 6. 单选题 | |
|
现有如下所示4个装置图,以下说法中正确的是( )
A . ①装置可用于比较NaHCO3和Na2CO3的稳定性
B . 用酒精萃取溴水中的溴可选择②装置
C . 如③装置进行实验可看到酸性KMnO4溶液褪色
D . ④装置可用于实验室制取并收集少量SO2
|
|
| 7. 实验探究题 | |
|
用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
|
|
| 8. 实验探究题 | |
|
水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略) 已知:3NaClO
|
|
| 9. 实验探究题 | |
|
Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 , 可作为高效安全灭菌消毒剂。如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
|
|
| 10. 实验探究题 | ||||||||||
|
某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行有关探究实验。
实验Ⅰ.制取氯酸钾、次氯酸钠和氯水
|
||||||||||
- 上海市普陀区2018-2019学年高考化学二模考试试卷
- 2015-2016学年甘肃省庆阳市宁县五中高二下学期期中化学试卷
- 广西桂林市2019-2020学年高一下学期化学期末考试试卷
- 2017年高考真题分类汇编(化学):专题1 化学与科技、社会、生活、环境
- 上海市青浦区2018-2019学年高三上学期化学期末考试试卷
- 2015-2016学年黑龙江省哈尔滨三十二中高一下学期期中化学试卷
- 2016-2017学年江西省赣州市四所高中联考高二下学期期中化学试卷
- 2018年全国Ⅰ卷高考化学模拟试卷
- 人教版化学高一必修1第二章第二节离子反应同步练习
- 高中化学鲁科版(2019)选择性必修2 第2章第1节 共价键模型
- 2016-2017学年湖南师大附中高二上学期期中化学试卷(理科)
- 广西省2017-2018学年高三理综-化学二模考试试卷

 SO2↑+Cl2↑
SO2↑+Cl2↑


 2NaCl+NaClO3
2NaCl+NaClO3