й«ҳдёӯеҢ–еӯҰдәәж•ҷзүҲпјҲ2019пјүеҝ…дҝ®з¬¬дёҖеҶҢ第дёүз« з¬¬дёҖиҠӮй“ҒеҸҠе…¶еҢ–еҗҲзү©
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳдёҖдёҠеӯҰжңҹ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еӨҡйҖүйўҳ | |
|
еҫҖCuOе’Ңй“ҒзІүзҡ„ж··еҗҲзү©дёӯпјҢеҠ е…ҘдёҖе®ҡйҮҸзҡ„зЁҖH2SO4 пјҢ 并еҫ®зғӯпјҢеҪ“еҸҚеә”еҒңжӯўеҗҺпјҢж»ӨеҮәдёҚжә¶зү©пјҢ并еҗ‘ж»Өж¶ІдёӯжҸ’е…ҘдёҖжһҡй“Ғй’үпјҢзүҮеҲ»еҗҺпјҢеҸ–еҮәй“Ғй’үпјҢеҸ‘зҺ°й“Ғй’үе№¶ж— д»»дҪ•еҸҳеҢ–пјҺж №жҚ®дёҠиҝ°зҺ°иұЎпјҢзЎ®е®ҡдёӢйқўиҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . дёҚжә¶зү©дёҖе®ҡжҳҜй“ң
B . дёҚжә¶зү©дёҖе®ҡжҳҜй“Ғ
C . дёҚжә¶зү©дёӯдёҖе®ҡеҗ«й“ңпјҢдҪҶдёҚдёҖе®ҡеҗ«й“Ғ
D . ж»Өж¶ІдёӯдёҖе®ҡеҗ«жңүFeSO4 пјҢ дёҖе®ҡжІЎжңүCuSO4
|
|
| 2. еҚ•йҖүйўҳ | |
|
жҹҗй»‘иүІзІүжң«еҸҜиғҪеҗ«жңүFeOгҖҒCuOгҖҒFeгҖҒCдёӯзҡ„дёүз§ҚжҲ–дёүз§Қд»ҘдёҠпјҢж №жҚ®дёӢеҲ—е®һйӘҢдәӢе®һеҫ—еҮәзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҸ–е°‘йҮҸеӣәдҪ“еҠ е…Ҙжө“硫酸并еҠ зғӯпјҢеӣәдҪ“е®Ңе…Ёжә¶и§ЈпјҢиҜҙжҳҺеҺҹеӣәдҪ“дёӯдёҖе®ҡжІЎжңүC
B . еҸ–5.0gеӣәдҪ“еңЁж°§ж°”жөҒдёӯе……еҲҶзҒјзғ§пјҢзҒјзғ§еҗҺеӣәдҪ“д»Қдёә5.0gпјҢиҜҙжҳҺеҺҹеӣәдҪ“дёӯдёҖе®ҡеҗ«жңүC
C . еҸ–е°‘йҮҸеӣәдҪ“еҠ е…Ҙи¶ійҮҸзЁҖзЎқй…ёеҗҺпјҢж»ҙе…ҘKSCNпјҢжә¶ж¶ІеҸҳзәўпјҢиҜҙжҳҺеҺҹеӣәдҪ“дёӯдёҖе®ҡеҗ«жңүFeO
D . з§°еҸ–дёҖе®ҡйҮҸеӣәдҪ“еҠ е…Ҙи¶ійҮҸзЁҖзЎ«й…ёпјҢе……еҲҶеҸҚеә”пјҢ收йӣҶеҲ°224mLпјҲж ҮеҮҶзҠ¶еҶөпјүж°”дҪ“пјҢиҝҮж»ӨпјҢжүҖеҫ—ж»ӨжёЈз»Ҹе№ІзҮҘеҗҺз§°еҫ—иҙЁйҮҸдёә0.64gпјҢеҺҹеӣәдҪ“дёӯдёҖе®ҡеҗ«жңүFeе’ҢCuOдё”n(Fe) вҲ¶n(CuO) =2вҲ¶1
|
|
| 3. еЎ«з©әйўҳ | |
|
FeSO4В·7H2Oжҷ¶дҪ“еңЁз©әж°”дёӯжҳ“иў«ж°§еҢ–пјҢдёәжЈҖйӘҢе…¶жҳҜеҗҰе·Іиў«ж°§еҢ–пјҢеҸҜеҸ–е°‘йҮҸж ·е“Ғжә¶дәҺйҖӮйҮҸж°ҙеҗҺеҠ е…ҘпјҲеЎ«еҢ–еӯҰејҸ)жә¶ж¶ІжЈҖйӘҢпјӣеҰӮе·Іж°§еҢ–пјҢеҸҜеҗ‘е…¶дёӯеҠ е…ҘиҝҮйҮҸд»ҘйҷӨеҺ»е…¶дёӯзҡ„Fe3+ гҖӮ
|
|
| 4. еҚ•йҖүйўҳ | |
|
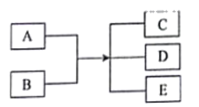
Aдёәеёёи§Ғзҡ„йҮ‘еұһеҚ•иҙЁпјҢж №жҚ®дёӢеӣҫжүҖзӨәзҡ„е…ізі»пјҡ
дёӢеҲ—еҸҷиҝ°дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . AдёәFeпјҢBдёәFe3O4
B . CвҶ’Dжә¶ж¶Ізҡ„йўңиүІеҸҳеҢ–пјҡз”ұжө…з»ҝиүІеҲ°й»„иүІ
C . в‘Јзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡFeпјӢFe3+=2Fe2+
D . ⑧зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ4Fe(OH)2пјӢO2пјӢ2H2O=4Fe(OH)3
|
|
| 5. жҺЁж–ӯйўҳ | |
|
е·ІзҹҘAпјҢBпјҢCпјҢDпјҢEжҳҜеҢ–еӯҰдёӯеёёи§Ғзҡ„зү©иҙЁгҖӮеёёжё©дёӢпјҢEжҳҜдёҖз§Қж— иүІж— е‘ізҡ„ж¶ІдҪ“пјҢе®ғ们д№Ӣй—ҙжңүеҰӮдёӢеҸҚеә”е…ізі»гҖӮ
|
|
| 6. з»јеҗҲйўҳ | |
|
|
| 7. еҚ•йҖүйўҳ | ||||||||||
|
жҹҗеҗҢеӯҰз”ЁKSCNжә¶ж¶Іе’ҢFeCl2жә¶ж¶ІжҺўз©¶Fe2+зҡ„иҝҳеҺҹжҖ§ж—¶еҮәзҺ°ејӮеёёзҺ°иұЎ,е®һйӘҢеҰӮдёӢпјҡ
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . в‘ЎдёӯзәўиүІжә¶ж¶Ідёӯеҗ«жңүFe(OH)3иғ¶дҪ“
B . е®һйӘҢв‘ЎдёӯеҸ‘з”ҹзҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”еҸӘжңүдёӨз§Қ
C . еҜ№жҜ”в‘ в‘Ўв‘ўпјҢеҸҜд»ҘеҲӨе®ҡй…ёжҖ§жқЎд»¶дёӢH2O2еҸҜд»Ҙж°§еҢ–SCN-
D . в‘ўдёӯеҸ‘з”ҹзҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”дёәпјҡ4Fe2++O2+4H+=4Fe3++2H2O
|
||||||||||
| 8. з»јеҗҲйўҳ | |
|
й“ҒжҳҜдёҖз§ҚйҮҚиҰҒзҡ„йҮ‘еұһжқҗж–ҷпјҢе®ғзҡ„еҚ•иҙЁеҸҠеҢ–еҗҲзү©еңЁз”ҹдә§з”ҹжҙ»дёӯеә”з”Ёе№ҝжіӣгҖӮ
|
|
| 9. еӨҡйҖүйўҳ | |
|
е·ҘдёҡдёҠз”Ёдәҡ铬酸дәҡй“Ғ[Fe(CrO2)2 ]еҲ¶еӨҮK2Cr2O7жҷ¶дҪ“зҡ„йғЁеҲҶе·ҘиүәжөҒзЁӢеҰӮдёӢжүҖзӨәпјҡ
е·ІзҹҘпјҡ4Fe(CrO2)2+10Na2CO3 +7O2 2H++2 дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . вҖңй«ҳжё©ж°§еҢ–вҖқиҝҮзЁӢдёӯеҸӘжңүCrе…ғзҙ иў«ж°§еҢ–
B . вҖңй…ёеҢ–вҖқзҡ„дё»иҰҒзӣ®зҡ„жҳҜдҪҝNa2CrO4иҪ¬еҸҳдёәNa2Cr2O7
C . вҖңж»ӨжёЈвҖқзҡ„дё»иҰҒжҲҗеҲҶжҳҜNa2SO4е’ҢNa2CO3
D . з”ҹжҲҗK2Cr2O7зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜпјҡNa2Cr2O7+2KCl=K2Cr2O7вҶ“+2NaCl
|
|
| 10. з»јеҗҲйўҳ | |
|
з”өеӯҗе·ҘдёҡдёӯпјҢеёёз”ЁFeCl3жә¶ж¶Іи…җиҡҖиҰҶеңЁз»қзјҳжқҝдёҠзҡ„й“ңз®”еҲ¶йҖ еҚ°еҲ·з”өи·ҜжқҝгҖӮеҢ–еӯҰе®һйӘҢе°Ҹз»„д»Һи…җиҡҖеәҹж¶І(еҗ«FeCl3гҖҒFeCl2гҖҒCuCl2)дёӯеӣһ收й“ң并йҮҚж–°иҺ·еҫ—FeCl3жҷ¶дҪ“зҡ„жөҒзЁӢеҰӮдёӢпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
- дә‘еҚ—зңҒжҳӯйҖҡеёӮжҳӯйҳіеҢә2019-2020еӯҰе№ҙй«ҳдёҖдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- еұұиҘҝзңҒй•ҝжІ»еёӮдёҠе…ҡиҒ”зӣҹ2018-2019еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·
- 2015-2016еӯҰе№ҙзҰҸе»әзңҒжјіе·һеёӮйҫҷжө·еёӮзЁӢжәӘдёӯеӯҰй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- еҢ—дә¬еёӮйЎәд№үеҢә2020е№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҜ•еҚ·
- ж№–еҚ—зңҒж№ҳиҘҝе·һ2018-2019еӯҰе№ҙй«ҳдәҢпјҲзҗҶ)дёҠеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·
- еӣӣе·қзңҒжҲҗйғҪеёӮйҫҷжіүй©ҝеҢә第дёҖдёӯеӯҰ2017-2018еӯҰе№ҙй«ҳдёүдёӢеӯҰжңҹзҗҶз»ј-еҢ–еӯҰ第дёҖж¬ЎжңҲиҖғиҖғиҜ•иҜ•еҚ·
- зҰҸе»әзңҒдёүжҳҺеёӮдёүең°дёүж Ў2017-2018еӯҰе№ҙй«ҳдёҖдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- дәәж•ҷзүҲеҢ–еӯҰй«ҳдёҖеҝ…дҝ®1第дәҢз« з¬¬дёүиҠӮж°§еҢ–иҝҳеҺҹеҸҚеә”еҗҢжӯҘз»ғд№
- 2016-2017еӯҰе№ҙе№ҝдёңзңҒж·ұеңіз§‘еӯҰй«ҳдёӯй«ҳдәҢдёҠеӯҰжңҹејҖеӯҰеҢ–еӯҰиҜ•еҚ·
- дәәж•ҷзүҲеҢ–еӯҰй«ҳдәҢйҖүдҝ®1第дёҖз« з¬¬еӣӣиҠӮз»ҙз”ҹзҙ е’Ңеҫ®йҮҸе…ғзҙ еҗҢжӯҘз»ғд№
- дёҠжө·еёӮиҷ№еҸЈеҢә2016-2017еӯҰе№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҖғиҜ•иҜ•еҚ·
- 2015-2016еӯҰе№ҙжұҹиҘҝзңҒиҒ”иҖғй«ҳдёҖдёҠеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·

 дёӘж•°жҜ”дёә3:1пјҢеҲҷиў«ж°§еҢ–дёҺиў«иҝҳеҺҹзҡ„ж°Ҝе…ғзҙ иҙЁйҮҸжҜ”дёәпјӣзҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
дёӘж•°жҜ”дёә3:1пјҢеҲҷиў«ж°§еҢ–дёҺиў«иҝҳеҺҹзҡ„ж°Ҝе…ғзҙ иҙЁйҮҸжҜ”дёәпјӣзҰ»еӯҗж–№зЁӢејҸдёәгҖӮ




 8Na2CrO4+4NaFeO2+10CO2
8Na2CrO4+4NaFeO2+10CO2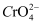 =
=  +H2O
+H2O



