内蒙古包头市2017-2018学年高考理综-化学一模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列化工生产过程中,未涉及氧化还原反应的是( )
A . 海带提碘
B . 氯碱工业
C . 氨碱法制碱
D . 海水提溴
|
|
| 2. 单选题 | |
|
化学与人类生活、社会密切相关。下列有关说法正确的是( )
A . 纤维素属于糖类,是人体中能量的重要来源
B . 维生素C具有还原性,能帮助人体将食物中摄取的不易吸收的Fe3+ , 转化为易吸收的Fe2+
C . 酶是蛋白质水解的催化剂,因此温度越高,越能加快蛋白质水解的速率
D . 用于3D 打印材料的光敏树酯是纯净物
|
|
| 3. 单选题 | |
|
设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A . 0.1mol NaHSO4晶体中,含有H+的数目为0.1NA
B . 46g C2H5OH中含极性共价键数目为7NA
C . 1L0.1mol·L-1的Na2CO3溶液中HCO3-和CO32-离子数目之和为0.1NA
D . 室温下,1L pH=7的CH3COONH4溶液中,由水电离产生的H+的数目为10-7NA
|
|
| 4. 单选题 | |
|
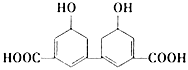
科学家从某中草药提取的有机物结构如下图所示。下列说法正确的是( )
A . 分子式为C14H10O6
B . 环上氢原子被取代,所得一氯代物有3种
C . 1mol该有机物与足量NaOH溶液反应最多消耗4mol NaOH
D . 该有机物的熔点可能比同碳原子的烃分子熔点高
|
|
| 5. 单选题 | ||||||||||||||||
|
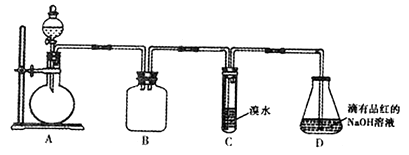
利用实验器材(规格和数量不限,夹持装置省略),能完成相应实验的一项是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 6. 单选题 | |
|
W、X、Y.、Z、Q是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为21,W与Y同主族,X与Z同主族,X是地壳中含量最多的元素。下列叙述一定正确的是( )
A . 原子半径是:Y>X>W
B . 简单氢化物的热稳定性:Z>X
C . 最高价氧化物对应水化物的酸性:Q>Z
D . X与Y形成的化合物只能含有离子键
|
|
| 7. 单选题 | |
|
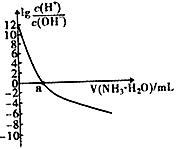
已知:25℃时,Kb(NH3·H2O)=1.8×10-5 , 该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg
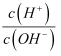 的关系如右图所示。下列说法错误的是( ) 的关系如右图所示。下列说法错误的是( )
A . a=10
B . HA为强酸
C . 25℃时,NH4+的水解平衡常数为
 ×10-9
D . 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-) ×10-9
D . 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
|
|
| 8. 综合题 | |||||||||||||
|
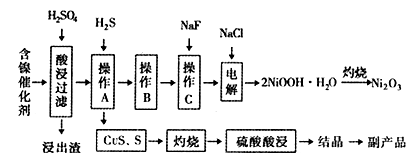
某实验科研小组研制了一种从废旧的含镍催化剂( 主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
回答下列问题:
|
|||||||||||||
| 9. 综合题 | |
|
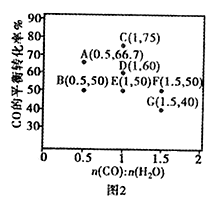
氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
|
|
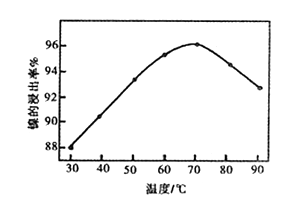
| 10. 综合题 | |||||||||||||||||||||
|
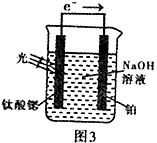
某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
|
|||||||||||||||||||||
 =。(常温时,Ksp(CaF2)=2.7×10-11)
=。(常温时,Ksp(CaF2)=2.7×10-11)
 H2(g)+
H2(g)+  O2(g)。该反应的平衡常数表达式为K=。
O2(g)。该反应的平衡常数表达式为K=。