山西省临汾市2021年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
能源、信息、材料是现代社会发展的三大支柱。下列相关说法正确的是( )
A . 一次性医用口罩用酒精消毒后重复使用不影响效果
B . 石油液化气与生物柴油主要成分都是烃类
C . 聚乙炔(
 )在任何条件下均不导电
D . 纯净的二氧化硅是现代光学与光纤制品的基本原料 )在任何条件下均不导电
D . 纯净的二氧化硅是现代光学与光纤制品的基本原料
|
|
| 2. 单选题 | |||||||||||||||||||||
|
利用下表提供的主要玻璃仪器(非玻璃仪器任选)和试剂能实现下列实验目的的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 3. 单选题 | |
|
我国科研人员使用催化剂CoGa3实现了H2选择性还原肉桂醛生成肉桂醇,反应机理示意图如下
下列说法错误的是( )
A . 肉桂醇分子式为C9H10O
B . 肉桂醛中官能团检验:先用溴水检验碳碳双键,再用银氨溶液检验醛基
C . 1 mol肉桂醇最多能与4 mol H2发生加成反应
D . 苯丙醛中最多有16个原子共平面
|
|
| 4. 单选题 | |||||||||||||||||
|
用图示装置探究Cl2的漂白原理,其中红纸①是干燥的,红纸②~④分别用下表中的试剂润湿。向中心Ca(ClO)2粉末上滴加几滴盐酸,迅速盖上培养皿,产生大量黄绿色气体,红纸变化如下。
下列对于该实验的分析错误的是( )
A . 对比①②的现象,说明红纸褪色涉及反应Cl2+H2O
 HCl+HClO
B . 对比②③的现象,不能说明能使红纸褪色的微粒是HClO
C . 对比②③④的现象,说明c(HClO)越大,漂白效果越好
D . ④中试剂可用碳酸钙悬浊液或Na2CO3溶液代替 HCl+HClO
B . 对比②③的现象,不能说明能使红纸褪色的微粒是HClO
C . 对比②③④的现象,说明c(HClO)越大,漂白效果越好
D . ④中试剂可用碳酸钙悬浊液或Na2CO3溶液代替
|
|||||||||||||||||
| 5. 单选题 | |
|
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中两种或三种元素组成的化合物,己是Z元素形成的单质。已知:甲+乙→丁+己,甲+丙→戊+己;25℃时,0.1 mol·L-1的丁溶液pH=13.下列说法错误的是( )
A . 1 mol甲与足量乙反应转移2 mol电子
B . 离子半径Z>W
C . 甲与丙反应时,既有离子键、共价键的断裂,又有离子键、共价键的形成
D . 四种元素可以组成化合物WXY2Z4
|
|
| 6. 单选题 | |
|
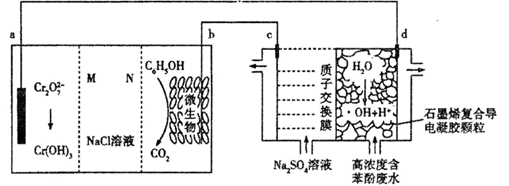
羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。一种能将苯酚(C6H5OH)氧化为CO2、H2O的原电池-电解池组合装置如图。该装置能实现发电、环保二位一体。下列说法错误的是( )
A . c极为阴极,M为阳离子交换膜
B . b极的电极反应式为C6H5OH-28e-+28OH-=6CO2↑+17H2O
C . d极区苯酚被氧化的反应为C6H5OH+28·OH=6CO2↑+17H2O
D . 右侧装置中,每转移0.7 mol e- , c、d两极共产生气体11.2L(标准状况)
|
|
| 7. 单选题 | |
|
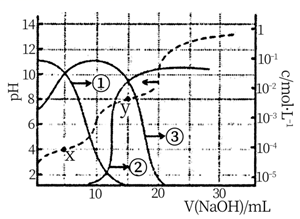
25℃时,用1.00 mol·L-1 NaOH溶液调节100 mL某二元弱酸H2A的pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示。下列说法正确的是( )
A . 曲线②代表c(HA-),曲线③代表c(A2-),H2A的Ka2=10-8
B . x点溶液中,n(Na+)=n(H2A)+n(HA-)+n(A2-)
C . 在Y点溶液中,c(Na+)>3c(A2-)
D . 0.1000 mol·L-1 NaHA溶液中,c(Na+)>c(HA-)>c(H2A)>c(A2-)
|
|
| 8. 综合题 | |
|
硫酸铅广泛应用于制造铅蓄电池、白色颜料以及精细化工产品3PbO·PbSO4·H2O(三盐)等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4的工艺流程如下:
已知:①PbCl2难溶于冷水,易溶于热水。 ②PbCl2(s)+2Cl-(aq) ③Ksp(PbSO4)=1.08×10-8 , Ksp(PbCl2)=1.6×10-5
|
|
| 9. 综合题 | |||||||||||||||||||||
|
叠氮化钠(NaN3)常用作汽车安全气囊及头孢类药物生产等。水合肼还原亚硝酸甲酯(CH3ONO)制备叠氮化钠(NaN3)的工艺流程如下:
ii.相关物质的物理性质如下表:
|
|||||||||||||||||||||
| 10. 综合题 | |
|
氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
|
|
- 2015年海南省白沙中学高考化学模拟试卷
- 人教版化学高二选修6第二单元实验2-3从海带中提取碘同步练习
- 河北省唐山市2019-2020学年高三上学期化学9月月考试卷
- 2016-2017学年江西省萍乡市高二下学期期末化学试卷
- 2015-2016学年安徽省六安市舒城县晓天中学高二下学期期中化学试卷
- 2016-2017学年山东省淄博市桓台二中高三上学期期中化学试卷
- 内蒙古杭锦后旗奋斗中学2016-2017学年高三上学期化学开学考试试卷
- 广东清远市2017—2018学年高三上学期理综-化学期末考试试卷
- 2020年江苏卷化学高考试题
- 天津市武清区2017-2018学年高二上学期化学期中考试试卷
- 辽宁省锦州市滨海新区2018-2019学年高三上学期化学12月月考测试卷
- 广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期化学9月月考试卷



 (aq) △H>0
(aq) △H>0
 已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
 ②科研小组模拟不同条件下的合成氨反应,向刚性容器中充人10.0 mol N2和20.0 mol H2 , 不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图2,T1、T2、T3由小到大的排序为;在T2、50MPa条件下,A点v正v逆(填“>”、“<”或“=”);在温度T2压强50 MPa时,平衡常数Kp=MPa-2(列出表达式,分压=总压×物质的量分数)。
②科研小组模拟不同条件下的合成氨反应,向刚性容器中充人10.0 mol N2和20.0 mol H2 , 不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图2,T1、T2、T3由小到大的排序为;在T2、50MPa条件下,A点v正v逆(填“>”、“<”或“=”);在温度T2压强50 MPa时,平衡常数Kp=MPa-2(列出表达式,分压=总压×物质的量分数)。


