广西梧州市2018-2019学年高二下学期化学期末考试试卷
教材版本:化学
试卷分类:化学高二下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列说法错误的是( )
A . 静置后的淘米水能产生丁达尔效应,这种淘米水具有胶体的性质
B . 商代后期铸造出工艺精湛的后母戊鼎,该鼎属于铜合金制品
C . 石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程
D . 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内可以延长水果的保鲜期
|
|
| 2. 单选题 | |
|
四元轴烯(a)、苯乙烯(b)、立方烷(c)的分子式均为C8H8 , 下列说法正确的是( )
A . a的同分异构体只有b和c两种
B . a、b、c均能使溴的四氯化碳溶液褪色
C . a、b分子中的所有原子一定处于同一平面
D . 不考虑立体结构,a、c的二氯代物均只有三种,b的一氯代物有五种
|
|
| 3. 单选题 | ||||||||||||||||
|
根据下列实验操作和现象所得到的结论正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 4. 单选题 | |
|
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A . 向1L0.1mol·L-1氯化铵溶液中通入少量氨气调节溶液为中性,则NH4+的数目大于0.1NA
B . 0.2 molNO和0.1molO2充分反应后,混合物的分子数为0.2NA
C . 64g铜丝加热下在硫黄蒸气里完全反应后,失去的电子数为NA
D . 14g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
|
|
| 5. 单选题 | |
|
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多。下列说法正确的是( )
A . N与M形成的化合物的水溶液显酸性
B . X有两种常见氧化物,所含的化学键类型完全相同
C . 离子半径:N>X,Y>M
D . 气态氢化物的稳定性:Y>M
|
|
| 6. 单选题 | |
|
水产养殖户常用电解法净化鱼池中的水,其工作原理如下图所示。下列说法中正确的是( )
A . X极是电源的负极,发生氧化反应
B . 工作过程中阴极区溶液的pH逐渐减小
C . 当电路中转移10mole-时,Ⅱ极上产生22.4LN2
D . I极上的电极反应式:C6H12O6-24e-+6H2O=6CO2↑+24H+
|
|
| 7. 单选题 | |
|
四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是( )
A . 在a、b、c、d、e中,水电离程度最大的点是d
B . c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C . 曲线I中c与e之间某点溶液呈中性
D . a点溶液pH=12
|
|
| 8. 实验探究题 | |
|
硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
|
|
| 9. 综合题 | |
|
乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
|
|
| 10. 综合题 | |||||||||||
|
|||||||||||





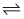 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H0(填“>”或“<”),CH4的平衡转化率为%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1(填“>”或“<”)T2 , t=s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H0(填“>”或“<”),CH4的平衡转化率为%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1(填“>”或“<”)T2 , t=s。




