北京市东城区2017-2018学年高考理综-化学二模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |||||
|
景泰蓝制作技艺是北京市的地方传统手工技艺,其制作工艺流程主要有
其工艺中一定含有化学变化的是( )
A . 裁剪
B . 掐丝
C . 烧蓝
D . 磨光
|
|||||
| 2. 单选题 | |
|
下列有关物质的用途错误的是( )
A . 液氨可做冷库的制冷剂
B . 食盐可做食品的防腐剂
C . 过氧化钠可做潜艇的供氧剂
D . 二氧化硫可做红酒的漂白剂
|
|
| 3. 单选题 | |
|
将碲化镉涂在玻璃上可制得“发电玻璃”。碲(Te)位于周期表的第五周期第VIA族,下列说法正确的是( )
A . 原子半径:Te>S
B . 单质的氧化性:Te>S
C . 最高正价:Te> S
D . 气态氢化物稳定性:H2Te> H2S
|
|
| 4. 单选题 | |
|
下列两种物质相互反应,无论两种物质的用量多少,都能用同一化学方程式表示的是( )
A . 碳酸钠溶液与稀盐酸反应
B . 硝酸银溶液与稀氨水反应
C . 氢氧化钡溶液与稀硫酸反应
D . 甲烷在光照条件下与氯气反应
|
|
| 5. 单选题 | |
|
由X、Y和Z合成缓释药物M,下列说法错误的是( )
A . M在体内能缓慢发生水解反应
B . X可以由乙烯通过加成反应和取代反应制备
C . 1mol Y与NaOH溶液反应,最多能消耗3mol NaOH
D . Z由加聚反应制得,其单体的结构简式是CH3CH=CHCOOH
|
|
| 6. 单选题 | |
|
我国研究锂硫电池获得突破,电池的总反应是16Li+S8
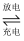 8Li2S ,充放电曲线如图所示,下列说法错误的是( ) 8Li2S ,充放电曲线如图所示,下列说法错误的是( )
A . 充电时,电能转化为化学能
B . 放电时,锂离子向正极移动
C . 放电时,1mol Li2S6转化为Li2S4得到2mole-
D . 充电时,阳极总电极反应式是8S2- -16e- = S8
|
|
| 7. 单选题 | |
|
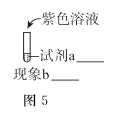
一定温度下,探究铜与稀HNO3 , 反应过程如下:
下列说法错误的是( )
A . 过程I中生成无色气体的离子方程式是3Cu+2 NO3-+8H+ =3Cu2++2NO↑+4H2O
B . 步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C . 由实验可知,NO2对该反应具有催化作用
D . 当活塞不再移动时,再抽入空气,铜可以继续溶解
|
|
| 8. 综合题 | |
|
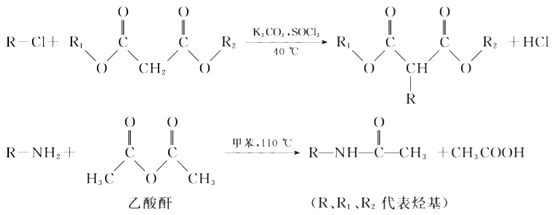
合成药物中间体M的流程如下。
已知:
|
|
| 9. 实验探究题 | |
|
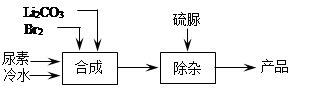
溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
已知:碳酸锂微溶于水,水溶液显碱性。
|
|
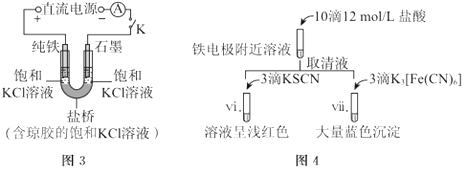
| 10. 实验探究题 | |
|
某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
|
|
- 辽宁省沈阳市2021-2022学年高一上学期期末质量监测化学试题
- 四川省凉山州2021年高考化学三模试卷
- 湖北省部分省重点中学2020-2021学年高二下学期化学3月月考试卷
- 江西省鹰潭市2022届高三第二次模拟考试理科综合化学试题
- 山东省日照市2021年高考化学三模试卷
- 广东省河源市河源高级中学2020-2021学年高一上学期化学期中考试试卷
- 福建省名校联盟2021-2022学年高二下学期期中考试化学试题.
- 福建省三明市三地三校2020-2021学年高一上学期化学期中考试试卷
- 广西来宾市2020-2021学年高一上学期期末教学质量检测化学试题
- 辽宁省沈阳市郊联体2021-2022学年高三上学期化学10月月考试卷
- 河南省新乡市2022届高三第三次模拟理科综合化学试题
- 安徽省马鞍山市和县2020-2021学年高一上学期化学期中考试试卷









 HBr +HBrO;
HBr +HBrO;

 ),没有沉淀产生。
),没有沉淀产生。