高中化学人教版(2019)选择性必修1 第三章第四节 沉淀溶解平衡
高中化学人教版(2019)选择性必修1 第三章第四节 沉淀溶解平衡
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列化学方程式中,不能正确表达反应颜色变化的是( )
A . 向
 溶液中加入足量Zn粉,溶液蓝色消失: 溶液中加入足量Zn粉,溶液蓝色消失:  B . 澄清的石灰水久置后出现白色固体:
B . 澄清的石灰水久置后出现白色固体:  C .
C .  在空气中放置后由淡黄色变为白色: 在空气中放置后由淡黄色变为白色:  D . 向
D . 向 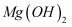 悬浊液中滴加足量 悬浊液中滴加足量 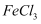 溶液出现红褐色沉淀: 溶液出现红褐色沉淀: 
|
|
| 2. 综合题 | |
|
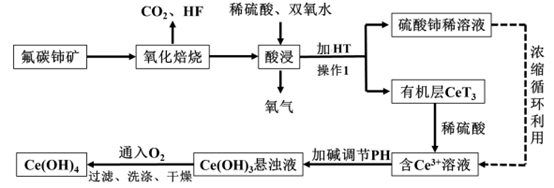
氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
|
|
| 3. 单选题 | |
|
25℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s)
 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( ) Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A . 溶液中Pb2+和I-浓度都增大
B . 溶度积常数KSP增大
C . 沉淀溶解平衡向左移动
D . 溶液中Pb2+浓度增大
|
|
| 4. 单选题 | |
|
已知Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A . AgCl>AgI>Ag2CrO4
B . AgCl>Ag2CrO4>AgI
C . Ag2CrO4>AgCl>AgI
D . Ag2CrO4>AgI>AgCl
|
|
| 5. 解答题 | |
|
已知Cu(OH)2的Ksp=2×10-20:某溶液中c(Cu2+)=0.02 mol·L-1 , 如要生成Cu(OH)2沉淀,应调整溶液的pH大于?(写步骤)
|
|
| 6. 单选题 | |
|
下列有关溶度积常数Ksp的说法正确的是( )
A . 常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B . 溶度积常数Ksp只受温度影响,温度升高Ksp减小
C . 溶度积常数Ksp只受温度影响,温度升高Ksp增大
D . 常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
|
|
| 7. 综合题 | |||||||||||||
|
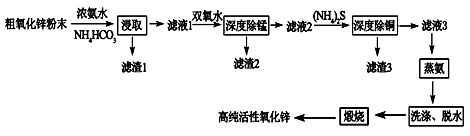
活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
几种难溶物的Ksp:
|
|||||||||||||
| 8. 单选题 | |
|
取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):
下列说法错误的是( )
A . 实验①白色沉淀是难溶的AgCl
B . 由实验②说明AgI比AgCl更难溶
C . 若按①③顺序实验,看不到黑色沉淀
D . 若按②①顺序实验,看不到白色沉淀
|
|
| 9. 单选题 | |
|
下列有关沉淀溶解平衡的说法正确的是( )
A . Ksp(AB2)小于Ksp(CD),则AB2的溶解度一定小于CD的溶解度
B . 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C . 在氯化银沉淀溶解平衡体系中,加入碘化钠固体,氯化银沉淀可转化为碘化银沉淀
D . 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
|
|
| 10. 单选题 | |
|
常温下,向10mL0.1mol·L-1KCl溶液和10mL0.1mol·L-1K2CrO4溶液中分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[表示-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为砖红色沉淀,下列说法不合理的是( )
A . bc所在曲线对应K2CrO4溶液
B . 常温下,Ksp(Ag2CrO4)<Ksp(AgCl)
C . 溶液中c(Ag+)的大小:a点>b点
D . 用0.1mol·L-1AgNO3标准液滴定上述KCl、K2CrO4溶液时,Cl-先沉淀
|
|
最近更新
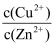 ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为mol/L。





