吉林省延边州2020年高考理综-化学4月模拟试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
我国的科技发展改变着人们的生活、生产方式。下列说法正确的是( )
A . 闻名世界的秦兵马俑是陶制品,由石灰石经高温烧结而成
B . “嫦娥四号”使用的SiC—Al材料属于复合材料
C . 5G芯片“巴龙5000”的主要材料是SiO2
D . 港珠澳大桥采用超高分子量聚乙烯纤维吊绳,其商品名为“力纶”,是有机高分子化合物,属于纯净物
|
|
| 2. 单选题 | |
|
已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A . 常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B . CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为
 C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
|
|
| 3. 单选题 | |
|
X、Y、Z、W、P是短周期主族元素,它们的原子序数依次增大,其中X的族序数=周期序数=原子序数,Y的最外层电子数等于其次外层电子数的2倍,它的一种核素常用于考古断代,W的一种单质被喻为“人类地球的保护伞”,P的最高正化合价与最低负化合价的代数和为4,下列说法正确的是( )
A . 由X、Z、P三种元素形成的化合物只能是共价化合物
B . Y、Z、W、P氢化物的稳定性依次增强
C . 食品中可适量添加PW2 , 起到去色、杀菌、抗氧化的作用
D . Y5X10W2能与碳酸氢钠反应的结构有三种
|
|
| 4. 单选题 | |
|
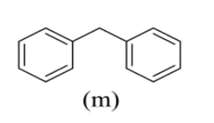
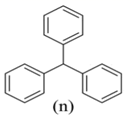
链烃分子中的氢被两个或多个苯基取代的化合物称为多苯代脂烃,m、n是两种简单的多苯代脂烃。下列说法正确的是( )
A . m、n互为同系物
B . m、n的一氯代物均只有四种
C . m、n均能使Br2的CCl4溶液褪色
D . m、n分子中所有碳原子处于同一平面
|
|
| 5. 单选题 | |||||||||||||||||||||
|
下列有关实验操作、现象与结论的说法错误的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
下列指定反应的离子方程式正确的是( )
A . 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
B . Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C . 惰性电极电解MgCl2溶液:2Cl−+2H2O
 Cl2↑+2OH-+ H2↑
D . 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- =BaSO4↓+H2O Cl2↑+2OH-+ H2↑
D . 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- =BaSO4↓+H2O
|
|
| 7. 单选题 | |
|
常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
A . B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B . 由图可知A-的水解平衡常数Kh约为1×10-9
C . C,E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D . F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
|
|
| 8. 综合题 | ||||||||||
|
重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO
 等)制备K2Cr2O7的流程如图所示。 等)制备K2Cr2O7的流程如图所示。 已知:I.在酸性条件下,H2O2能将Cr2O Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答下列问题:
|
||||||||||
| 9. 综合题 | ||||||||||||||||||||||||||||||||
|
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
|
||||||||||||||||||||||||||||||||
| 10. 综合题 | |
|
材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
|
|
- 人教(新课标)高中化学一轮复习:专题9化学反应与能量
- 2015-2016学年山东省聊城市莘县实验高级中学高三上学期期中化学试卷
- 广东省肇庆市2016-2017学年高一上学期化学期末考试试卷
- 吉林省榆树一中五校联考2018-2019学年高一上学期化学期末考试试卷
- 高中化学鲁科版(2019)必修第一册 第1章 单元测试
- 上海市黄浦区2018-2019学年高考化学一模考试试卷
- 福建省福州八县一中2018-2019学年高一上学期化学期中考试试卷
- 山东省菏泽市2018-2019学年高考理综-化学一模考试试卷
- 江苏省盐城市2017-2018学年高一下学期化学期末考试试卷
- 上海市浦东新区2016-2017学年高二上学期化学期末考试试卷
- 高中化学人教版(2019)必修第二册 第六章测试卷
- 安徽省滁州市定远县西片区2018-2019学年高一上学期化学期中考试试卷


 还原为Cr3+;
还原为Cr3+;
 O(NO气体)
O(NO气体)  2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1 , 对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1 , 对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下: 
 =(计算结果用分数表示)
=(计算结果用分数表示)





