江西省赣州市2017-2018学年高考理综-化学5月模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活、生产密切相关。下列说法正确的是( )
A . 使用大量肥料和农药来增加农作物的产量
B . 聚乳酸和聚氯乙烯常用一次性快餐盒的材料
C . 矿物油溅在衣服上可用热纯碱溶液去除
D . 补血剂硫酸亚铁片与维生素C同时服用效果更佳
|
|
| 2. 单选题 | |
|
三国时期曹植在《七步诗》中这样写到“煮豆持作羹,漉豉以为汁。萁在釜下燃,豆在釜中泣。……”,文中“漉”涉及的化学实验基本操作是( )
A . 过滤
B . 分液
C . 升华
D . 蒸馏
|
|
| 3. 单选题 | |
|
有机物m、n、P存在如下转化关系。下列说法正确的是( )
A . m、n不存在同分异构体,p存在多种同分异构体
B . m、n、p均能使酸性高锰酸钾溶液褪色
C . m、n、p中所有原子可能共面
D . 等质量的m、n、p,完全燃烧耗氧量不相等
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列根据实验现象得出的实验结论正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+ , 其原理如图所示。下列说法正确的是( )
A . H+由右室进入左室
B . Ce4+从电解槽的c口流出,且可循环使用
C . 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D . 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
|
|
| 6. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法错误的是( )
A . 离子半径大小关系:Y>Z>X>W
B . YX2遇到蓝色石蕊试液先变红后褪色
C . 简单阴离子的还原性:Y>Z
D . Y与Z属于同一周期,与X属于同一主族
|
|
| 7. 单选题 | |
|
常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是( )
A . NaH2A水溶液呈碱性
B . H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+
 c(HA2-)+ c(HA2-)+ 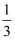 c(A3-)
C . 向H3A溶液中加入一定量的NaOH溶液至pH=5时, c(A3-)
C . 向H3A溶液中加入一定量的NaOH溶液至pH=5时,  D . 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
D . 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
|
|
| 8. 实验探究题 | |||||||
|
实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
实验过程: I.配制含0.10mol FeSO4的绿矾溶液。 II.制备FeCO3: 向配制好的绿矾溶液中,缓慢加入200mL 1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。 III.制备(H2NCH2COO)2Fe: 实验装置如下图(夹持和加热仪器已省略),将实验II 得到的沉淀和含0.20mol 甘氨酸的水溶液混合后加入C 中,然后利用A 中反应产生的气体将C 中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
|
|||||||
| 9. 实验探究题 | |
|
铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
已知:I.铍、铝元素化学性质相似 II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
|
|
| 10. 综合题 | |
|
氢气是一种清洁、高效新能源,也是重要的化工原料。
|
|
- 高中化学鲁科版(2019)必修第二册 第2章第1节 化学键与物质构成
- 2016-2017学年河南省郑州市八校联考高一下学期期中化学试卷
- 山东省菏泽市2017-2018学年高一上学期化学期中考试试卷(B)
- 浙江省衢州市2019-2020学年高二下学期化学期末考试试卷
- 广西2018-2019学年高一下学期化学第一次月考模拟卷
- 吉林省吉林市2018-2019学年高二(文)上学期化学期中考试试卷
- 人教高中化学一轮复习:专题12电化学
- 湖北省武汉市2017-2018学年高考理综-化学5月模拟考试试卷
- 2015-2016学年山东省深泉学院高一下学期期中化学试卷
- 高中化学人教版选修4 第二章 单元测试卷
- 2013年海南省高考化学试卷
- 广东省云浮市2019-2020学年高二下学期化学期末考试试卷






 CO(g)+3H2(g)
CO(g)+3H2(g) 



