2018年高考化学真题分类汇编专题05:化学反应与能量
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | ||||||||||||||||
 催化重整不仅可以得到合成气(CO和 催化重整不仅可以得到合成气(CO和  )。还对温室气体的减排具有重要意义。回答下列问题: )。还对温室气体的减排具有重要意义。回答下列问题:
|
||||||||||||||||
| 2. 单选题 | |
|
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法错误的是:( )
A . 生成CH3COOH总反应的原子利用率为100%
B . CH4→CH3COOH过程中,有C-H键发生断裂
C . ①→②放出能量并形成了C一C键
D . 该催化剂可有效提高反应物的平衡转化率
|
|
| 3. 综合题 | |
|
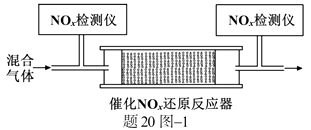
NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
|
|
| 4. 多选题 | |
|
炭黑是雾霾中和重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫,下列说法正确的是( )
A . 每活化一个氧分子吸收0.29 eV的能量
B . 水可使氧分子活化反应的活化能降低0.42eV
C . 氧分子的活化是O—O的断裂与C—O键的生成过程
D . 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
|
|
| 5. 综合题 | |||||||||||||||||||||||||
|
过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:
|
|||||||||||||||||||||||||
- 人教版化学高二选修3第二章第二节分子的立体结构同步练习
- 2016-2017学年山东省菏泽市高二上学期期中化学试卷(b)
- 天津市和平区2017-2018学年高一上学期化学期末考试试卷
- 四川省南江中学高二11月月考化学试卷
- 2016-2017学年江苏省徐州市邳州市运河中学高三上学期开学化学试卷
- 贵州省遵义市2019-2020学年高二下学期化学期末考试试卷
- 2015-2016学年江西省宜春市高安二中高一上学期期中化学试卷(奥赛班)
- 浙江省金衢六校联考2015-2016学年高一上学期化学期中考试试卷
- 2017年湖南省郴州市高考化学一模试卷
- 人教版高中化学选修四化学反应原理综合
- 2015-2016学年甘肃省天水三中高二下学期第一次月考化学试卷
- 2015-2016学年四川省宜宾三中高一上学期月考化学试卷(1月份)
 。
。






 。有利于提高
。有利于提高  平衡转化率的条件是(填标号)。
平衡转化率的条件是(填标号)。 以及催化剂进行重整反应。达到平衡时
以及催化剂进行重整反应。达到平衡时  的转化率是50%,其平衡常数为
的转化率是50%,其平衡常数为  。
。




 (k为速率常数)。在
(k为速率常数)。在  一定时,不同
一定时,不同  下积碳量随时间的变化趋势如右图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为
下积碳量随时间的变化趋势如右图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为



 O2(g)=H20(1) △H1=-286kJ·mol-1
O2(g)=H20(1) △H1=-286kJ·mol-1



