ж№–еҚ—еёҲеӨ§йҷ„дёӯ2017-2018еӯҰе№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰдёҖжЁЎиҖғиҜ•иҜ•еҚ·
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳиҖғ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
дҪ“иӮІз«һжҠҖдёӯжңҚз”Ёе…ҙеҘӢеүӮж—ўжңүеӨұе…¬е№іпјҢд№ҹиҙҘеқҸдәҶдҪ“иӮІйҒ“еҫ·пјҺжҹҗз§Қе…ҙеҘӢеүӮзҡ„з»“жһ„з®ҖејҸеҰӮеӣҫжүҖзӨәпјҺжңүе…іиҜҘзү©иҙЁзҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
A . иҜҘзү©иҙЁдёҺиӢҜй…ҡеұһдәҺеҗҢзі»зү©пјҢйҒҮFeCl3жә¶ж¶Іе‘Ҳзҙ«иүІ
B . ж»ҙе…Ҙй…ёжҖ§KMnO4жә¶ж¶ІжҢҜиҚЎпјҢзҙ«иүІиӨӘеҺ»пјҢиғҪиҜҒжҳҺе…¶з»“жһ„дёӯеӯҳеңЁзўізўіеҸҢй”®
C . иҜҘеҲҶеӯҗдёӯзҡ„жүҖжңүзўіеҺҹеӯҗдёҚеҸҜиғҪе…ұе№ійқў
D . 1molжӯӨзү©иҙЁеҲҶеҲ«дёҺжө“жәҙж°ҙе’ҢH2еҸҚеә”ж—¶жңҖеӨҡж¶ҲиҖ—Br2е’ҢH2дёә4molе’Ң7mol
|
|
| 2. еҚ•йҖүйўҳ | ||||||||||||||||
|
ж №жҚ®дёӢеҲ—е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎжүҖеҫ—еҲ°зҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 3. еҚ•йҖүйўҳ | |
|
еҢ–еӯҰдёҺз”ҹжҙ»пјҢзӨҫдјҡеҸ‘еұ•жҒҜжҒҜзӣёе…ігҖҒдёӢеҲ—жңүе…іиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . вҖңйңҫе°ҳз§ҜиҒҡйҡҫи§Ғи·ҜдәәвҖқгҖӮйӣҫйңҫжүҖеҪўжҲҗзҡ„ж°”жә¶иғ¶жңүдёҒиҫҫе°”ж•Ҳеә”
B . вҖңжӣҫйқ’(зЎ«й…ёй“ң)ж¶Ӯй“ҒпјҢй“ҒиөӨиүІеҰӮй“ңвҖқиҝҮзЁӢдёӯеҸ‘з”ҹдәҶзҪ®жҚўеҸҚеә”
C . дёәйҳІжӯўдёӯз§ӢжңҲйҘјзӯүеҜҢи„ӮйЈҹе“Ғеӣ иў«ж°§еҢ–иҖҢеҸҳиҙЁпјҢеёёеңЁеҢ…иЈ…иўӢдёӯж”ҫе…Ҙз”ҹзҹізҒ°жҲ–зЎ…иғ¶
D . еҢ»з”Ёй…’зІҫдҪ“з§ҜеҲҶж•°жҳҜ75%пјҢз”ЁеҢ»з”Ёй…’зІҫиҸҢж¶ҲжҜ’жҳҜдҪҝз»ҶиҸҢгҖҒз—…жҜ’иӣӢзҷҪиҙЁеҸҳжҖ§еҗҺжӯ»дәЎ
|
|
| 4. еҚ•йҖүйўҳ | |
|
NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еңЁж ҮеҮҶзҠ¶еҶөдёӢ.11.2Lдёҷзғ·еҗ«жңүзҡ„жһҒжҖ§й”®ж•°зӣ®дёә5NA
B . 7gй”ӮеңЁз©әж°”дёӯе®Ңе…ЁзҮғзғ§ж—¶иҪ¬з§»зҡ„з”өеӯҗж•°дёәNA
C . 1molи‘Ўиҗ„зі–(C6H12O6)еҲҶеӯҗеҗ«жңүзҡ„зҫҹеҹәж•°зӣ®дёә6NA
D . еёёжё©дёӢпјҢ0.2L0.5mol/LNH4NO3жә¶ж¶Ідёӯеҗ«жңүзҡ„ж°®еҺҹеӯҗж•°е°ҸдәҺ0.2NA
|
|
| 5. еҚ•йҖүйўҳ | |||||||||||||
|
е·Ҙдёҡй…ёжҖ§еәҹж°ҙдёӯзҡ„Cr2O72-еҸҜиҪ¬еҢ–дёәCr3+йҷӨеҺ»пјҢе®һйӘҢе®Өз”Ёз”өи§Јжі•жЁЎжӢҹиҜҘиҝҮзЁӢпјҢз»“жһңеҰӮдёӢиЎЁжүҖзӨә(е®һйӘҢејҖе§Ӣж—¶жә¶ж¶Ізҡ„дҪ“з§ҜеқҮдёә50mLпјҢCr2O72-зҡ„иө·е§Ӣжө“еәҰгҖҒз”өеҺӢгҖҒз”өи§Јж—¶й—ҙеқҮзӣёеҗҢ)гҖӮдёӢеҲ—иҜҙжі•дёӯпјҢй”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . еҜ№жҜ”е®һйӘҢв‘ в‘ЎеҸҜзҹҘпјҢйҷҚдҪҺpHеҸҜд»ҘжҸҗй«ҳCr2O72-зҡ„еҺ»йҷӨзҺҮ
B . е®һйӘҢв‘ўдёӯпјҢзҗҶи®әдёҠз”өи·ҜдёӯжҜҸйҖҡиҝҮ6molз”өеӯҗпјҢе°ұжңү1molCr2O72-иў«иҝҳеҺҹ
C . е®һйӘҢв‘ЎдёӯпјҢCr2O72-еңЁйҳҙжһҒж”ҫз”өзҡ„з”өжһҒеҸҚеә”ејҸжҳҜCr2O72-+6e-+14H+=2Cr3++7H2O
D . е®һйӘҢв‘ўдёӯпјҢC2O72-еҺ»йҷӨзҺҮжҸҗй«ҳзҡ„еҺҹеӣ жҳҜCr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
|
|||||||||||||
| 6. еҚ•йҖүйўҳ | |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ AгҖҒBгҖҒCгҖҒDзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮе·ІзҹҘAгҖҒCзҡ„еҺҹеӯҗеәҸж•°д№Ӣе·®дёә8пјҢAгҖҒBгҖҒCдёүз§Қе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә15пјҢBе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°зӯүдәҺAе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°зҡ„дёҖеҚҠпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . з®ҖеҚ•зҰ»еӯҗзҡ„еҚҠеҫ„пјҡBпјһCпјһDпјһA
B . BдёҺCеҪўжҲҗзҡ„еҢ–еҗҲзү©еңЁж°ҙжә¶ж¶ІдёӯиғҪзЁіе®ҡеӯҳеңЁ
C . CдёҺDйғҪеҸҜеҪўжҲҗе…·жңүжјӮзҷҪжҖ§зҡ„еҢ–еҗҲзү©пјҢдё”жјӮзҷҪеҺҹзҗҶзӣёеҗҢ
D . BдёҺDеҪўжҲҗзҡ„еҢ–еҗҲзү©жә¶дәҺж°ҙжүҖеҫ—жә¶ж¶Іжҳҫй…ёжҖ§
|
|
| 7. еҚ•йҖүйўҳ | |
|
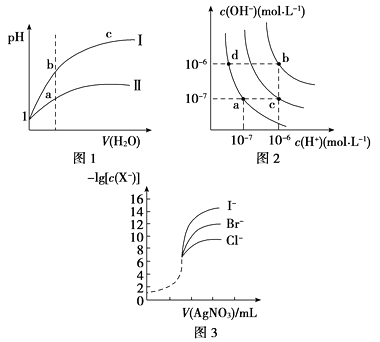
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”зҡ„еҸҷиҝ°зӣёз¬Ұзҡ„жҳҜ( )
A . еӣҫ1иЎЁзӨәеҗҢжё©еәҰдёӢпјҢpHпјқ1зҡ„зӣҗй…ёе’ҢйҶӢй…ёжә¶ж¶ІеҲҶеҲ«еҠ ж°ҙзЁҖйҮҠж—¶pHзҡ„еҸҳеҢ–жӣІзәҝпјҢе…¶дёӯжӣІзәҝв…Ўдёәзӣҗй…ёпјҢдё”bзӮ№жә¶ж¶Ізҡ„еҜјз”өжҖ§жҜ”aзӮ№ејә
B . еӣҫ2дёӯзәҜж°ҙд»…еҚҮй«ҳжё©еәҰпјҢе°ұеҸҜд»Ҙд»ҺaзӮ№еҸҳеҲ°cзӮ№
C . еӣҫ2дёӯеңЁbзӮ№еҜ№еә”жё©еәҰдёӢпјҢе°ҶpHпјқ2зҡ„H2SO4дёҺpHпјқ10зҡ„NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢжә¶ж¶ІжҳҫдёӯжҖ§
D . з”Ё0.010 0 mol/LзЎқ酸银ж ҮеҮҶжә¶ж¶ІпјҢж»ҙе®ҡжө“еәҰеқҮдёә0.100 0 mol/L ClпјҚгҖҒBrпјҚеҸҠIпјҚзҡ„ж··еҗҲжә¶ж¶ІпјҢз”ұеӣҫ3жӣІзәҝпјҢеҸҜзЎ®е®ҡйҰ–е…ҲжІүж·Җзҡ„жҳҜClпјҚ
|
|
| 8. е®һйӘҢжҺўз©¶йўҳ | |
|
дәҡзЎқй…°ж°Ҝ(ClNO)жҳҜжңүжңәзү©еҗҲжҲҗдёӯзҡ„йҮҚиҰҒиҜ•еүӮпјҢдёәзәўиӨҗиүІж¶ІдҪ“жҲ–й»„иүІж°”дҪ“пјҢе…·жңүеҲәйј»жҒ¶иҮӯе‘ігҖҒйҒҮж°ҙеҸҚеә”з”ҹжҲҗдёҖз§Қж°ҜеҢ–зү©е’ҢдёӨз§Қж°®еҢ–зү©гҖӮжҹҗеӯҰд№ е°Ҹз»„еңЁе®һйӘҢз©әз”ЁCl2е’ҢNOеҲ¶еӨҮClNO并жөӢе®ҡе…¶зәҜеәҰпјҢзӣёе…іе®һйӘҢиЈ…зҪ®(еӨ№жҢҒиЈ…зҪ®з•ҘеҺ»)еҰӮдёӢеӣҫжүҖзӨәгҖӮиҜ·еӣһзӯ”пјҡ
|
|
| 9. е®һйӘҢжҺўз©¶йўҳ | |
|
й”Ңй’ЎзҷҪжҳҜдёҖз§ҚзҷҪиүІйўңж–ҷпјҢе·ҘдёҡдёҠз”ұZnSO4дёҺBaSжә¶ж¶Іж··еҗҲиҖҢжҲҗпјҢBaS+ZnSO4=ZnSвҶ“+BaSO4вҶ“гҖӮиҜ·ж №жҚ®д»ҘдёӢе·Ҙдёҡз”ҹдә§жөҒзЁӢеӣһзӯ”жңүе…ій—®йўҳгҖӮ
|
|
| 10. з»јеҗҲйўҳ | |
|
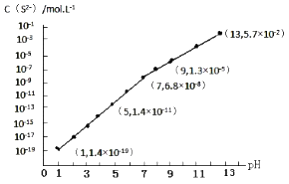
зЎ«еҢ–ж°ў(H2S)зҡ„иҪ¬еҢ–жҳҜиө„жәҗеҲ©з”Ёе’ҢзҺҜеўғдҝқжҠӨзҡ„йҮҚиҰҒз ”з©¶иҜҫйўҳгҖӮ
|
|
- е®үеҫҪзңҒж·®еҚ—еёӮ2022еұҠй«ҳдёү第дәҢж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰиҜ•йўҳ
- еҢ—дә¬еёӮжңқйҳіеҢә2022еұҠй«ҳдёү дәҢжЁЎеҢ–еӯҰиҜ•йўҳ
- е№ҝдёңзңҒжҪ®е·һеёӮ2022еұҠй«ҳдёүдёӢеӯҰжңҹ第дәҢж¬ЎжЁЎжӢҹиҖғиҜ•еҢ–еӯҰиҜ•йўҳ
- жө·еҚ—зңҒзҗјжө·еёӮ2022еұҠй«ҳдёүжЁЎжӢҹиҖғиҜ•пјҲдёүжЁЎпјүеҢ–еӯҰиҜ•йўҳ
- ж№–еҚ—зңҒиЎЎйҳіеёӮ2022еұҠй«ҳдёүдёӢеӯҰжңҹиҒ”иҖғ пјҲдёүжЁЎпјүеҢ–еӯҰиҜ•йўҳ
- еұұдёңзңҒжөҺеҚ—еёӮ2022еұҠй«ҳдёүдёӢеӯҰжңҹ5жңҲжЁЎжӢҹиҖғиҜ•пјҲдёүжЁЎпјүеҢ–еӯҰиҜ•йўҳ
- еұұиҘҝзңҒеӨӘеҺҹеёӮ2022еұҠй«ҳдёүдёӢеӯҰжңҹдёүжЁЎиҖғиҜ•зҗҶз»јеҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒиҝһдә‘жёҜеёӮ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹжңҹжң«и°ғз ”иҖғиҜ•еҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒе®ҝиҝҒеёӮжІӯйҳіеҺҝ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹжңҹжң«и°ғз ”жөӢиҜ•еҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒеҫҗе·һеёӮ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹжңҹжң«жҠҪжөӢеҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒжү¬е·һеёӮ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰпјҲйҖүдҝ®пјүиҜ•йўҳ
- иҫҪе®ҒзңҒйһҚеұұеёӮ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•йўҳ



 Sn2пјҚеҶҷеҮәз”өи§Јж—¶йҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҡгҖӮ
Sn2пјҚеҶҷеҮәз”өи§Јж—¶йҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҡгҖӮ



