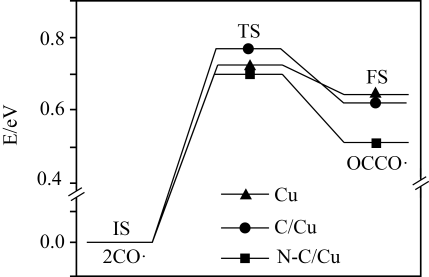山西省太原市2022届高三下学期三模考试理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
“神舟十三号”乘组航天员在空间站进行了三次“天宫授课”。以下实验均在太空中进行,下列说法正确的是( )
A . “泡腾片实验”中,柠檬酸与小苏打反应时,有电子的转移
B . “太空冰雪实验”中,过饱和乙酸钠溶液结晶,该过程放出热量
C . “太空五环实验”中,向乙酸溶液中滴加甲基橙溶液后变成黄色
D . “水油分离实验”中,不需其他操作,静置即可实现水和油的分离
|
|
| 2. 单选题 | |
|
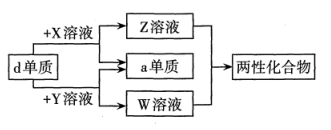
a、b、c、d、e为原子序数依次增大的短周期主族元素。X、Y、Z、W为这些元素形成的常见化合物,X为二元化合物,常温下0.1mol/L X溶液的pH=1。物质之间的转化关系如图所示。
下列说法正确的是( )
A . 简单离子半径:e>d> b
B . b、c形成的化合物中都不含共价键
C . Z、W都能破坏水的电离平衡
D . b的氢化物稳定性一定强于e的氢化物
|
|
| 3. 单选题 | |
|
我国科学家利用Co的化合物在Fe(OH)2氧化过程中的催化作用,促进了电催化过程中流失的Fe催化活性中心的原位自修复(Fe再沉积的主要反应过程) ,反应机理如图所示。下列说法错误的是( )
A . 反应过程中CoOOH为催化剂
B . 图中各反应不能在酸性条件下进行
C . 存在反应Co(OH)2+OH- -e- =CoOOH+H2O
D . 图中所示物质之间的转化有非极性键的形成和断裂
|
|
| 4. 单选题 | |
|
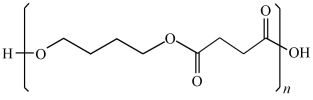
PBS是一种新型的全生物降解塑料,它是以丁二醇(C4H10O2)和丁二酸(C4H6O4)合成的聚酯加工而成,其结构如图所示。下列说法正确的是( )
A . 丁二醇和丁二酸均可以发生消去反应
B . PBS塑料和PE(聚乙烯)塑料均属于加聚反应的产物
C . 若不考虑立体异构和两个羟基同时连在同一个碳原子上的结构,则丁二醇共有6种结构
D . 1,4-丁二醇(
|
|
| 5. 单选题 | |
|
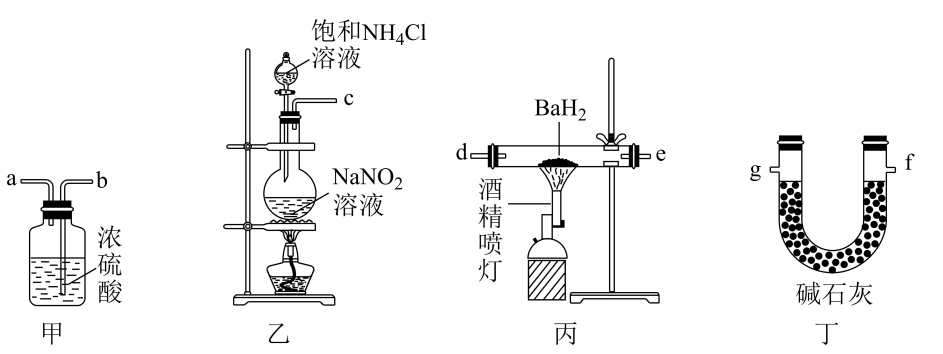
氮化钡( Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡,在实验室可用如图装置制备(每个装置只用一次)。已知: Ba3N2遇水反应; BaH2在潮湿空气中能自燃,遇水反应。下列说法错误的是( )
A . 实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯
B . 该实验装置中缺少尾气处理装置
C . 按气流方向,装置的连接顺序可为c→b→a→d→e→g
D . 装置甲中的浓硫酸和装置丁中的碱石灰均可防止水蒸气进入装置丙中
|
|
| 6. 单选题 | |
|
某微生物燃料电池在废水处理和新能源开发领域具有广阔的应用前景,其工作原理如图所示。下列说法正确的是( )
A . 电极电势a< b,电极b上发生氧化反应
B . HS-在硫氧化菌作用下发生反应 HS-+ 4H2O- 8e- =
 +9H+
C . 若该电池外电路有0.4 mol电子转移,则 有0.45molH+迁移到b极。
D . 该燃料电池在高温下进行效率更高 +9H+
C . 若该电池外电路有0.4 mol电子转移,则 有0.45molH+迁移到b极。
D . 该燃料电池在高温下进行效率更高
|
|
| 7. 单选题 | |
|
常温下,二元酸H2A的Ka1=1.3 ×10-7 , Ka2=7.1×10-15 , 难溶盐CuA、ZnA饱和溶液中沉淀溶解平衡时相关离子浓度的变化如图所示,已知Ksp (CuA)< Ksp(ZnA)。下列说法错误的是( )
A . m线表示CuA饱和溶液中相关离子的浓度变化,且Ksp(CuA )的数量级为10-37
B . a点对应的可以是CuA的不饱和溶液,也可以是ZnA的不饱和溶液
C . 向p点的溶液中加入少量Na2A固体,溶液组成可能变为q点
D . 向等浓度、等体积的稀H2SO4中分别加入少许等物质的量的ZnA和CuA两种固体,ZnA、CuA都能溶解
|
|
| 8. 实验探究题 | |
|
高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为(NH4)2[Ce(NO3)6] ,是一种橙红色单斜细粒结晶,易溶于水,几乎不溶于浓硝酸。实验室由9.99%的碳酸铈制备硝酸高铈铵时的主要步骤如下:
I.取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解,配成一定浓度的硝酸铈溶液,过滤后待用。在搅拌条件下,向硝酸铈溶液中加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黃色难溶物)。 II.将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体,二者反应生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。 回答下列问题:
|
|
| 9. 综合题 | |
|
金属钨具有高熔点、低蒸气压、导热性好等特点,是等离子体材料的最佳候选材料。一种以黑钨矿(也叫钨锰铁矿,主要成分是FeWO4和MnWO4)为原料生产金属钨及含钨产品的工业流程如下图所示:
已知:“水浸”后滤液中的阴离子主要是
|
|
| 10. 综合题 | |
|
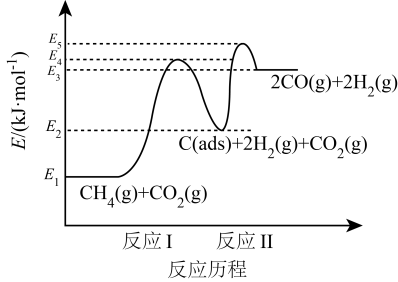
在“碳达峰、碳中和”的目标引领下,对减少二氧化碳排放的相关技术研究正成为世界各国的前沿发展方向。回答下列问题:
|
|
- 2015-2016学年江西省赣州市高二上学期期末化学试卷
- 2016-2017学年宁夏银川市育才中学高一上学期期中化学试卷
- 2019年初中化学中考难点专练 17 有机化学基础
- 人教版化学高二选修4第四章第四节金属的电化学腐蚀与防护同步练习
- 2015年云南省保山市腾冲县高考化学模拟试卷
- 人教版化学高二选修4第四章第三节电解池同步练习
- 高中化学人教版(2019)选择性必修1第三章第二节水的电离和溶液pH
- 高中化学鲁科版(2019)选择性必修2 第3章测试卷
- 人教版化学高二选修6第三单元实验3-3植物体中某些元素的检验同步练习
- 湖南省五市十校2017-2018学年高一上学期化学期中考试试卷
- 山西省忻州市第二中学2019-2020学年高二下学期化学3月月考试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表





 、
、 、
、 、
、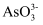 和
和 。
。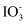 离子交换柱发生反应:
离子交换柱发生反应: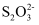 =2I-+
=2I-+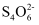 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为,(列出计算式,无需化简)
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为,(列出计算式,无需化简)