山西省晋中市2020年高考化学三模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
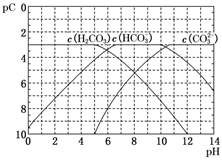
pC类似于pH,是指极稀溶液中溶质浓度的负对数。常温下向H2CO3溶液中逐滴滴加NaOH溶液,测得溶液的pC与pH关系如图所示。下列说法错误的是( )
A . 在同一溶液中,H2CO3、HCO3–、CO32–不能大量共存
B . H2CO3二级电离平衡常数Ka2的数量级等于10–11
C . 当pH=7时,溶液中
 >3
D . 向H2CO3溶液滴加NaOH溶液至溶液呈中性的过程中, >3
D . 向H2CO3溶液滴加NaOH溶液至溶液呈中性的过程中,  逐渐变小 逐渐变小
|
|
| 2. 单选题 | |
|
化学与生产、生活、社会息息相关,下列说法错误的是( )
A . 血液透析是胶体的化学性质,“人工肾”利用血液透析原理救治危重新冠肺炎患者
B . 漂白粉是一种常用杀菌消毒剂,其主要成分是氯化钙和次氯酸钙
C . “用浓酒和糟入甑(蒸锅),蒸气令上……”,其中涉及的操作是蒸馏
D . 医用口罩无纺布的原材料成分之一是聚丙烯,其结构简式为

|
|
| 3. 单选题 | |
|
某化合物的结构简式为
 ,下列说法正确的是( ) ,下列说法正确的是( )
A . 分子中所有原子可能共平面
B . 该化合物的一氯取代物有4种
C . 易溶于水和四氯化碳
D . 只能发生加成和取代反应,不能发生氧化反应
|
|
| 4. 单选题 | |
|
某实验小组拟利用如图装置制取干燥的氮气。下列说法错误的是( )
A . 装置I中发生的反应为NaNO2+NH4Cl
 NaCl+N2↑+2H2O
B . 加热片刻后需要将酒精灯移开,说明该反应是放热反应
C . 装置II的作用是冷凝水蒸气
D . 在装置III末端收集纯净干燥的N2只能用向下排空气法 NaCl+N2↑+2H2O
B . 加热片刻后需要将酒精灯移开,说明该反应是放热反应
C . 装置II的作用是冷凝水蒸气
D . 在装置III末端收集纯净干燥的N2只能用向下排空气法
|
|
| 5. 单选题 | |
|
环戊烯是生产精细化工产品的重要中间体,其工业制备原理如图1。以Pd/Al2O3为催化剂,在相同反应时间内,测得不同温度下(其他条件相同)环戊二烯转化率与环戊烯产率的变化曲线如图2。下列说法正确的是( )
A . 环戊二烯的转化率越大,越有利于环戊烯的生成
B . a点是主反应的平衡转化率,b点是副反应的平衡转化率
C . 30℃~35℃之间环戊烯产率变化趋势与环戊二烯转化率不一致,原因是主反应被抑制,使环戊烯产率降低
D . 30℃时催化剂的选择性最好,有利于提高生成环戊烯的平衡转化率
|
|
| 6. 单选题 | |
|
乙二醛(OHC–CHO)是重要的精细化工产品。工业上电解乙二醛和盐酸的混合液制备乙醛酸(OHC–COOH)的装置如图所示,通电后,阳极产物将乙二醛氧化为乙醛酸。下列说法错误的是( )
A . a为电源的正极,c电极反应式为2Cl–-2e–=Cl2
B . 当1mol乙二醛氧化成1mol乙醛酸时,阴极生成22.4L(标准状况)气体
C . 电解过程中稀H2SO4电解液的浓度保持不变
D . 阳极液中盐酸的作用有生成氧化剂、增强溶液导电性、提供离子平衡阴极区电荷
|
|
| 7. 单选题 | |
|
X、Y、Z、W为原子序数依次增大的短周期主族元素,它们形成的某种化合物阴离子结构如图。其中X、Z为同主族元素,Y最外层电子数是内层的3倍,W最外层电子数为核外电子总数的
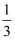 ,下列说法正确的是( ) ,下列说法正确的是( )
A . 简单氢化物稳定性:W>Y
B . ZX与X2Y反应,ZX做还原剂,1molZX转移电子数为2NA
C . X2WY2–具有还原性
D . X、Z分别与Y形成的二元化合物中含有的化学键类型完全不同
|
|
| 8. 综合题 | |
|
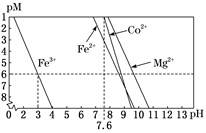
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2 , 及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
回答下列问题:
|
|
| 9. 实验探究题 | |
|
聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:
回答下列问题:
|
|
| 10. 综合题 | |
|
CO在工农业生产中有着重要的应用。
|
|








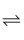 Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的  倍。则:
倍。则:  =。
=。



