山东省聊城市2017-2018学年高考理综-化学三模考试试卷
山东省聊城市2017-2018学年高考理综-化学三模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
“中国名片”中航天,军事、天文等领城的发展受到世界瞩目,它们与化学有着密切联系。下列说法错误的是( )
A . “中国天眼”的“眼眶”是钢铁结成的圈梁,其属于黑色金属材料
B . “歼—20” 飞机上大量使用的碳纤维是一种新型有机高分子材料
C . “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
D . “天宫二号”空间实验室的硅电池板将光能直接转换为电能
|
|
| 2. 单选题 | |
|
阿伏加德罗常数的值为NA , 实验室制备联氨(N2H4)的化学方程式为:2NH3 +NaClO=N2H4 +NaCl+ H2O。下列说法正确的是( )
A . 0.1molN2H4中所含质子数为1. 8NA
B . 0. 1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA
C . 消耗4.48LNH3时,转移电子数为0.2NA
D . 1.6g N2H4中存在共价键总数为0.2NA
|
|
| 3. 单选题 | |
|
关于化合物
A . b、d、p都属于芳香烃,且互为同分异构体
B . b、d、p的一氯代物均只有三种
C . b、d、p均可与溴的四氯化碳溶液反应
D . b、d、p中b、d的所有原子可能处于同一平面
|
|
| 4. 单选题 | |
|
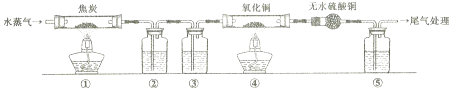
灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2 , 为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是( )
A . 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B . ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C . ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D . 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
|
|
| 5. 单选题 | |
|
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是( )
A . 简单离子的半径:Y>Z>X
B . 简单氢化物的沸点:Y>X
C . 最高价氧化物对应水化物的碱性:Z>Y
D . W、Y的氧化物所含化学键类型相同
|
|
| 6. 单选题 | |
|
高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。 工业上可用电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是( )
A . 阳极电极反应式:Fe-6e- +8OH-=FeO42- +4H2O
B . 甲溶液可循环利用
C . 离子交换膜a是阴离子交换膜
D . 当电路中通过2mol电子的电量时,会有1molH2生成
|
|
| 7. 单选题 | |
|
向25℃时,体积均为20mL、浓度均为0. 1mol·L-1的两种酸HX、HY溶液中分別滴加0. 1mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
A . HX与NaOH溶液反应的离子方程式为:HX +OH-=X-+H2O
B . Ka(HY)的数量级约为10-10
C . b点时: c(Na+)=c(Y-)+c(HY)
D . V(NaOH)= 20mL时,两种反应后的溶液中c(X-)>c(Y-)
|
|
| 8. 实验探究题 | |
|
莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl
 2FeCl3+C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2 , 按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下: 2FeCl3+C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2 , 按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
回答下列问题:
|
|
| 9. 实验探究题 | |||||||||||||||||||
|
利用废钡渣(主要成分为BaS2O3 , 含少量SiO2)为原料生产高纯氟化钡的流程如下:
已知:Kap(BaS2O3)=6.96×10-11 , Kap(BaF2)=1.0×10-6
|
|||||||||||||||||||
| 10. 综合题 | |
|
煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
|
|
最近更新







 CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。 
 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=。



