备考2021年高考化学二轮专题 第2讲 非金属元素及其化合物
备考2021年高考化学二轮专题 第2讲 非金属元素及其化合物
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
中学常见反应的化学方程式是A+B
 X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答: X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
|
|
| 2. 综合题 | |
|
|
| 3. 综合题 | |
|
海水中溴含量约为65mg·L-1 , 从海水中提取溴的工艺流程如图:
|
|
| 4. 单选题 | |
|
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
A . 洗气瓶中产生的沉淀是碳酸钡
B . 在Z导管出来的气体中无二氧化碳
C . 洗气瓶中产生的沉淀是亚硫酸钡
D . 在Z导管口有红棕色气体出现
|
|
| 5. 综合题 | |
|
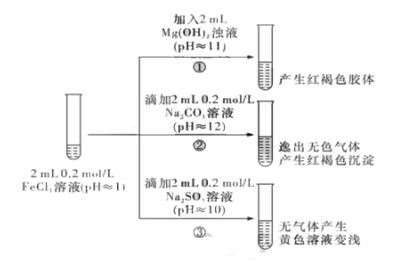
从宏观现象探究微观本质是重要的化学学科素养。
|
|
| 6. 单选题 | |
|
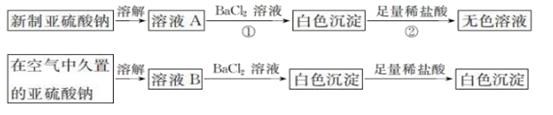
浓硫酸分别和三种钠盐反应,下列分析正确的是( )
A . 对比①和②可以说明还原性Br->Cl-
B . ①和③相比可说明氧化性Br2>SO2
C . ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D . ③中浓H2SO4被还原成SO2
|
|
| 7. 实验探究题 | |
|
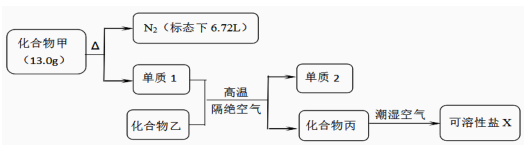
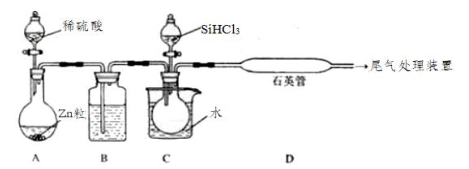
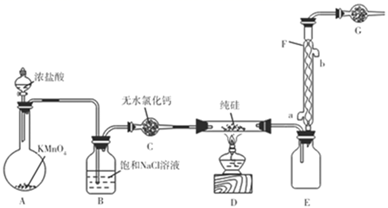
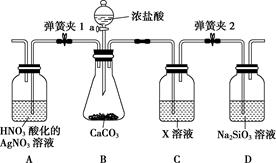
“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用。
已知有关信息: ①Si+3HCl ②SiCl4遇水剧烈水解,SiCl4的熔点、沸点分别为-70.0 ℃、57.7 ℃。 请回答下列问题:
|
|
| 8. 单选题 | |
|
有关下图海洋中部分资源的利用的说法错误的是( )
A . 工业上用Cl2与澄清石灰水反应制取漂白粉
B . 用MgCl2·6H2O晶体制无水MgCl2 , 需在HCl气流中加热脱水
C . SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr
D . 粗碘中混有少量ICl和IBr,可加入KI进行升华提纯
|
|
| 9. 单选题 | |
|
在标准状况下,将O2和NO按体积比3:4充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )
A .
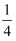 mol/L
B . mol/L
B .  mol/L
C . mol/L
C .  mol/L
D . mol/L
D . 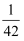 mol/L mol/L
|
|
| 10. 综合题 | |
|
写出下列反应的离子方程式(已知还原性:
 ): ):
|
|
高中化学 试卷推荐
- 2016年四川省遂宁市高考化学二诊试卷
- 高中化学鲁科版(2019)必修第二册 第1章测试卷
- 吉林省汪清县第六中学2019-2020学年高一上学期化学期中考试试卷
- 山西省长治市2018-2019学年高一下学期理科综合(化学)3月月考试卷
- 高中化学人教版(2019)必修第一册第一章第三节 氧化还原反应
- 2016-2017学年山东省淄博市淄川一中高二下学期期中化学试卷
- 云南省昭通市水富县云天化中学2016-2017学年高二上学期化学期末考试试卷(理科)
- 四川省蓬安县第二中学2019-2020学年高一下学期化学开学考试卷
- 山西省太原市2017-2018学年高考理综-化学三模考试试卷
- 2016-2017学年广东省肇庆市高一上学期期末化学试卷
- 人教版化学高二选修3第三章第一节晶体的常识同步练习
- 人教版高中化学选修五 第二章第一节:脂肪烃
最近更新

 =
=  +Br-+CO2↑
+Br-+CO2↑

 SiHCl3+H2 , Si+2Cl2
SiHCl3+H2 , Si+2Cl2 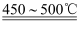 SiCl4
SiCl4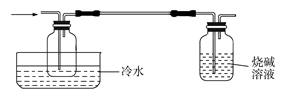

 溶液中通入少量
溶液中通入少量  (
(  与
与  ):;
):;
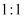 :。
:。



