安徽省马鞍山市2022届高三下学期第三次教学质量监测(三模) 理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活、生产、环境、科技密切相关。下列说法正确的是( )
A . 酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
B . 煤的干馏与石油的催化裂化均属于化学变化
C . 纳米铁粉通过物理吸附可除去污水中的Pb2+、Cu2+、 Cd2+、 Hg2+等
D . “神舟十三号”宇宙飞船返回舱外表面使用的新型高温结构陶瓷主要成分是硅酸盐
|
|
| 2. 单选题 | |
|
维生素C又称“抗坏血酸”,广泛存在于水果蔬菜中,结构简式如图所示。下列关于维生素C的说法正确的是( )
A . 分子式为C6H6O6
B . 1mol 维生素C与足量的Na反应,可生成标准状况下22.4LH2
C . 与
 互为同分异构体
D . 可用酸性高锰酸钾溶液检验其中的碳碳双键 互为同分异构体
D . 可用酸性高锰酸钾溶液检验其中的碳碳双键
|
|
| 3. 单选题 | |
|
下列指定反应的离子方程式正确的是( )
A . 用氨水吸收足量的SO2气体: 2NH3·H2O + SO2= 2
 + +  + H2O
B . 将Cl2通入石灰乳中制漂白粉: Cl2+ 2OH- = ClO- + Cl-+ H2O
C . ZnCO3 溶于稀盐酸: + H2O
B . 将Cl2通入石灰乳中制漂白粉: Cl2+ 2OH- = ClO- + Cl-+ H2O
C . ZnCO3 溶于稀盐酸:  + 2H+= H2O + CO2↑
D . 向AgBr悬浊液中滴加足量Na2S溶液,出现黑色沉淀: 2AgBr(s)+S2- (aq)=Ag2S(s) +2Br-(aq) + 2H+= H2O + CO2↑
D . 向AgBr悬浊液中滴加足量Na2S溶液,出现黑色沉淀: 2AgBr(s)+S2- (aq)=Ag2S(s) +2Br-(aq)
|
|
| 4. 单选题 | ||||||||||||||||
|
由下列实验操作及现象所得结论或解释错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
短周期元素X、Y、Z、Q、R的原子序数依次增大,且X、Y、Q、R的原子的最外层电子数之和为12,X与R同主族,Q是地壳中含量最高的元素。下列说法错误的是( )
A . 简单离子半径大小顺序为: Z>Q>R
B . 最简单氢化物的沸点高低顺序为: Q>Z> Y
C . X与Q形成的化合物仅含共价键
D . Q与R形成的常见化合物中,阴、阳离子数目之比为1∶2
|
|
| 6. 单选题 | |
|
用间接电解法对NO进行无害化处理,其原理如图所示。下列说法正确的是( )
A . 工作时电解池中H+从左室移向右室
B . 阳极电极反应式为2
 + 2H++ 2e-= + 2H++ 2e-=  + 2H2O
C . 理论上每处理1molNO,电解池中产生32g O2
D . 吸收塔中反应的离子方程式为2NO + 2 + 2H2O
C . 理论上每处理1molNO,电解池中产生32g O2
D . 吸收塔中反应的离子方程式为2NO + 2 + 2H2O = N2+ 4 + 2H2O = N2+ 4
|
|
| 7. 单选题 | |
|
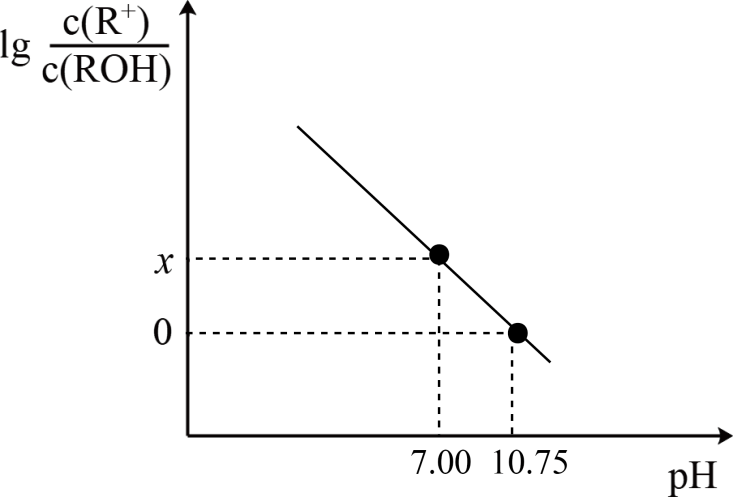
MOH是一种一元弱碱,25℃时, 在20.0mL 0.1 mol·L-1MOH溶液中滴加0.1 mol·L-1盐酸V mL, 混合溶液的pH与
 的关系如图所示。下列说法错误的是( ) 的关系如图所示。下列说法错误的是( )
A . x=3.75
B . a点时,V=10.0 mL
C . 25℃时, MOH的电离常数Kb的数量级为10-4
D . V=20.0 mL时,溶液存在关系: 2c(H+) + c(M+) = c(MOH) +2c(OH-)+ c(Cl-)
|
|
| 8. 实验探究题 | |
|
化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献。某化学兴趣小组在实验室中模拟侯氏制碱法制备NaHCO3 , 进一步 得到产品Na2CO3和NH4Cl两种产品,并测定碳酸钠中碳酸氢钠的含量。过程如下:
|
|
| 9. 综合题 | |
|
合理处理金属垃圾既可以保护环境又可以节约资源。利用废旧镀锡铜线制备胆矾并回收锡的流程如下:
已知Sn2+容易水解。 回答下列问题:
|
|
| 10. 综合题 | |
|
甲醇是一种重要的液体清洁燃料,工业上有多种制备甲醇的方法。
|
|
- 江苏省高邮市临泽中学2020-2021学年高二下学期化学6月月考试卷
- 山西省运城市高中联合体2020-2021学年高一上学期化学期中考试试卷
- 四川省广安市2020-2021学年高二下学期期末考试化学联考试题
- 湖湘教育三新探索协作体2020-2021学年高二上学期化学期中考试试卷
- 安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题
- 河南省新郑市2021-2022学年高二上学期化学第一次月考试卷
- 河南省郑州市十校2021-2022学年高一下学期期中联考化学试题
- 辽宁省辽南协作体2020-2021学年高一上学期化学期中考试试卷
- 上海市静安区2021-2022学年上学期期末考试高一化学试卷
- 四川省成都附属实验中2020-2021学年高三上学期化学10月月考试卷
- 安徽省皖北县中联盟2021-2022学年高二上学期12月联考化学试题
- 安徽省示范高中皖北协作区2021年高考化学模拟试卷


 CaCO3+H2CO3 , 随Ca2+浓度增加,平衡向右移动
CaCO3+H2CO3 , 随Ca2+浓度增加,平衡向右移动

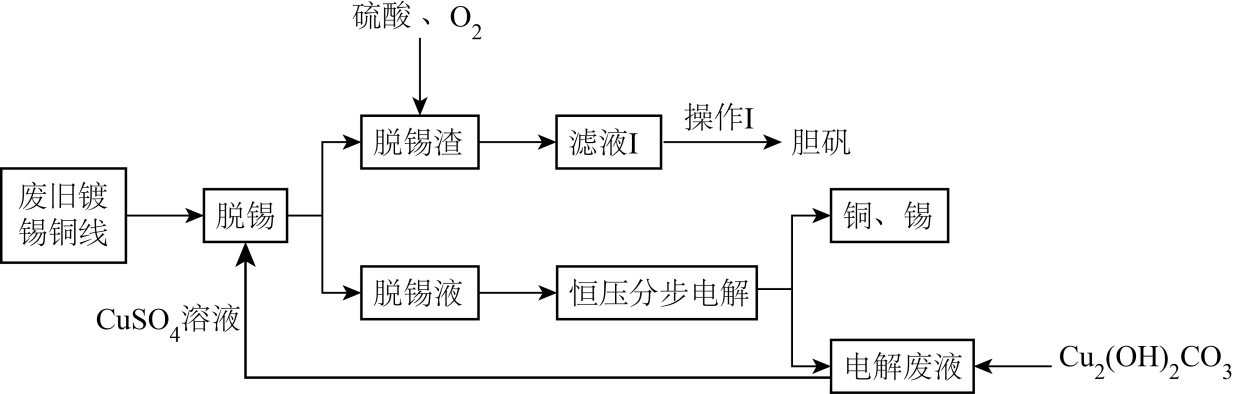
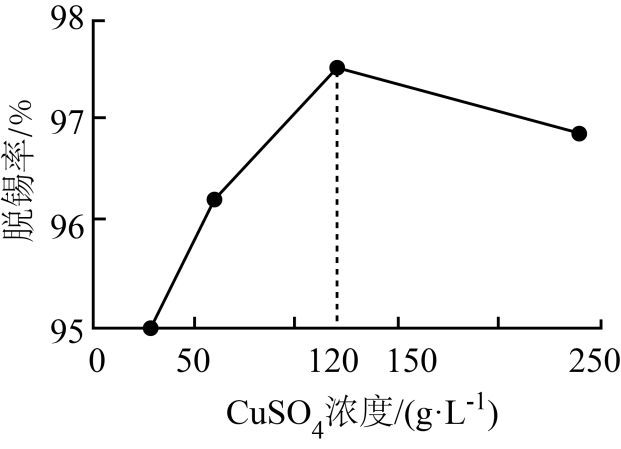
 , 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。
, 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。
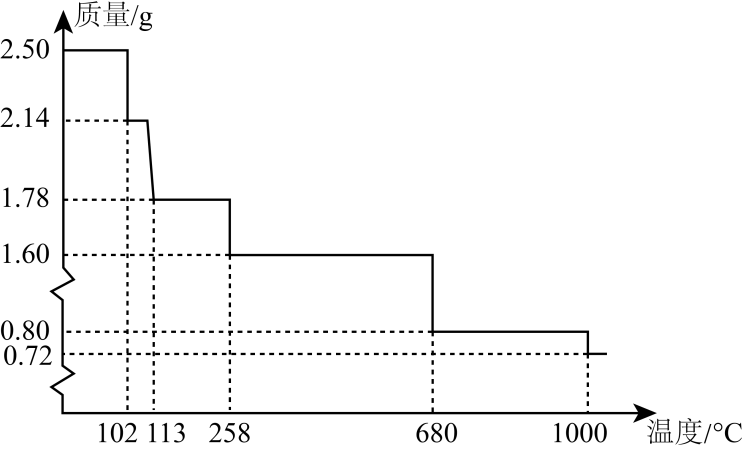
 = 3。
= 3。



