四川省成都附属实验中2020-2021学年高三上学期化学10月月考试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )
A . 化学式为C6H6O6
B . 乌头酸能发生水解反应和加成反应
C . 乌头酸能使酸性高锰酸钾溶液褪色
D . 含1mol乌头酸的溶液最多可消耗3 mol NaOH
|
|
| 2. 单选题 | |
|
W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是( )
A . 4种元素中Y的金属性最强
B . 最高价氧化物对应的水化物的酸性:Z>X
C . 简单阳离子氧化性:W>Y
D . W和Y形成的化合物与水反应能生成一种还原性气体
|
|
| 3. 单选题 | |
|
唐代刘禹锡撰于818年的《传信方》中有这样一段描述“治气痢巴石丸,取白矾一大斤,以炭火净地烧令汁尽,则其色如雪,谓之巴石”。据此推测,用于治气痢的巴石丸,其主要原料的化学成分为( )
A . CuSO4
B . FeSO4·7H2O
C . KAl(SO4)2·12H2O
D . Fe2(SO4)3·9H2O
|
|
| 4. 单选题 | |
|
化学知识在生产和生活中有着重要的应用。下列说法中正确的是( )
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等 ②K、Na合金可作原子反应堆的导热剂 ③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 ④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等 ⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂 ⑥明矾常作为消毒剂
A . ①②③④
B . ①②③④⑤
C . ①②③④⑥
D . ①②③④⑤⑥
|
|
| 5. 单选题 | |||||||||||||||||||||
|
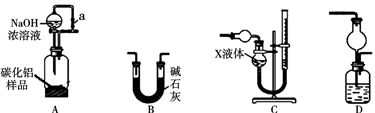
下列实验所用试剂、现象和结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
铝—空气燃料电池具有原料易得、能量密度高等优点,装置如图所示,电池的电解质溶液为KOH溶液。下列说法正确的是 ( )
A . 放电时,消耗氧气22.4 L(标准状况),有4 mol OH-从左往右通过阴离子交换膜
B . 充电时,电解池阳极区的电解质溶液中c(OH-)逐渐增大
C . 放电过程的负极反应式:Al+3OH--3e-=Al(OH)3↓
D . 充电时,铝电极上发生还原反应
|
|
| 7. 单选题 | |
|
硫酸钡是一种比碳酸钡更难溶的物质。常温下-lg c(Ba2+)随-lg c(CO32-)或-lg c(SO42-)的变化趋势如图,下列说法正确的是( )
A . 趋势线A表示硫酸钡
B . 常温下,Ksp(BaCO3)=1×10-11
C . 将碳酸钡和硫酸钡固体置于水中,此时溶液中的
 =10
D . 在硫酸钡悬浊液中,若要使0.1 mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1 mol =10
D . 在硫酸钡悬浊液中,若要使0.1 mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1 mol
|
|
| 8. 实验探究题 | |
|
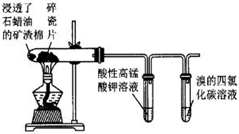
碳化铝(Al4C3)用于冶金及催化剂,可由两种单质在高温下直接化合来制备,含有大量氮化铝(AlN)和少量Al2O3 .
已知:①AlN+NaOH+H2O=NaAlO2+NH3↑. ②Al4C3与水接触,会很快放出易燃气体甲烷,并生成氢氧化铝。 为测定某Al4C3样品的含量,设计如下实验方案:取一定量的样品,选择以下装置测定样品中Al4C3的纯度(夹持仪器已略去).
|
|
| 9. 综合题 | |
|
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②酸性条件下,ClO3-不会氧化Co2+ , ClO3-转化为Cl-; ③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L) ④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。 请回答:
|
|
| 10. 综合题 | |
|
硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
|
|
- 广东省广州市2020年高考理综-化学3月模拟试卷(全国I卷)
- 2017_2018学年高中化学新人教版必修二 第一章 第一节 元素周期表
- 人教版高中化学选修五 第四章 第一节 油 脂 同步练习
- 2016-2017学年福建省泉州市惠南中学高一上学期期中化学试卷
- 新疆维吾尔自治区生产建设兵团第一师高级中学2018-2019学年高一上学期化学期末考试试卷
- 2015-2016学年陕西省宝鸡市金台区高一下学期期中化学试卷
- 2020高考化学常考知识点专练 06:电池
- 2016-2017学年江西省宜春三中高二上学期期中化学试卷
- 人教高中化学一轮复习:专题5常见的金属元素
- 2015-2016学年山东省枣庄市滕州十一中高三上学期期末化学模拟试卷(四)
- 备考2018年高考化学一轮基础复习:专题32 定量实验和化学实验的设计与评价
- 2015-2016学年江苏省徐州市高二上学期期末化学试卷









 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O。
=CaSO3↓+2NH3·H2O。 S(l)+2CO2(g)
S(l)+2CO2(g) ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。




