еӣӣе·қзңҒеҚ—е……еёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёүжЁЎиҜ•еҚ·
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳиҖғ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
еҢ–еӯҰдёҺз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . дёәйҳ»жӯўж–°еһӢеҶ зҠ¶з—…жҜ’дј ж’ӯпјҢеҸҜеҲ©з”Ё84ж¶ҲжҜ’ж¶ІеҜ№зҺҜеўғиҝӣиЎҢж¶ҲжҜ’
B . з»ҙз”ҹзҙ Cе…·жңүиҫғејәзҡ„ж°§еҢ–жҖ§пјҢеёёз”ЁдҪңж°§еҢ–еүӮ
C . дёӯеӣҪдј з»ҹеҲ¶жІ№жқЎзҡ„еҸЈиҜҖжҳҜвҖңдёҖзўұгҖҒдәҢзҹҫгҖҒдёүй’ұзӣҗвҖқпјҢе…¶дёӯвҖңзўұвҖқжҳҜзҒ«зўұ
D . жҲ‘еӣҪиҮӘдё»з ”еҸ‘зҡ„5GиҠҜзүҮжқҗж–ҷжҳҜдәҢж°§еҢ–зЎ…
|
|
| 2. еҚ•йҖүйўҳ | |
|
е®Өжё©дёӢH2SO4жҳҜдәҢе…ғејәй…ёпјҢе…¶зЁҖжә¶ж¶ІдёӯпјҢ第дёҖжӯҘи§ЈзҰ»жҳҜе®Ңе…Ёзҡ„пјҢ第дәҢжӯҘи§ЈзҰ»зЁӢеәҰиҫғдҪҺпјҢHSO
  HпјӢпјӢSO HпјӢпјӢSO  (K2=1.0Г—10-2)гҖӮи®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү (K2=1.0Г—10-2)гҖӮи®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 56 gеҚ•иҙЁй“ҒдёҺи¶ійҮҸзЁҖзЎ«й…ёеҸҚеә”дә§з”ҹ22.4 L H2
B . 1 L 0.1 mol/Lзҡ„зЎ«й…ёжә¶ж¶ІдёӯпјҢеҗ«HпјӢзҡ„ж•°зӣ®дёә0.2 NA
C . е®Өжё©дёӢпјҢNaHSO4жә¶ж¶ІжҳҫзўұжҖ§
D . зЁҖзЎ«й…ёжә¶ж¶ІдёӯеӯҳеңЁе…ізі»пјҡc(HSO
 )пјӢc(OH-)пјӢ2c(SO )пјӢc(OH-)пјӢ2c(SO  )=c(HпјӢ) )=c(HпјӢ)
|
|
| 3. еҚ•йҖүйўҳ | |
|
з»ҝеҺҹй…ёе…·жңүеҫҲй«ҳзҡ„иҚҜз”Ёд»·еҖјпјҢе…¶з»“жһ„еҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . иҜҘзү©иҙЁдёҚиғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІ
B . е…¶иӢҜзҺҜдёҠзҡ„дёҖж°Ҝд»Јзү©жңүдёүз§Қ
C . 1 molз»ҝеҺҹй…ёдёҺ5 mol H2еҸ‘з”ҹеҠ жҲҗеҸҚеә”
D . еҲҶеӯҗдёӯжүҖжңүCеҺҹеӯҗеҸҜиғҪе…ұйқў
|
|
| 4. еҚ•йҖүйўҳ | |
|
WгҖҒXгҖҒYгҖҒZдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢдё”еҲҶеұһдәҺдёүдёӘдёҚеҗҢе‘Ёжңҹзҡ„зҹӯе‘Ёжңҹе…ғзҙ пјҢXгҖҒYеҗҢе‘ЁжңҹгҖӮXгҖҒYгҖҒZеҸҜеҪўжҲҗдёҖз§Қж— иүІеү§жҜ’ж°”дҪ“(з»“жһ„еҰӮеӣҫжүҖзӨә)пјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . XгҖҒYгҖҒZеҪўжҲҗзҡ„з®ҖеҚ•ж°ўеҢ–зү©дёӯYзҡ„ж°ўеҢ–зү©зҶ”жІёзӮ№жңҖй«ҳ
B . Zе…ғзҙ еҪўжҲҗзҡ„еҗ«ж°§й…ёеқҮдёәејәй…ё
C . WдёҺXгҖҒYеқҮиғҪеҪўжҲҗиҮіе°‘2з§ҚдәҢе…ғеҢ–еҗҲзү©
D . еҺҹеӯҗеҚҠеҫ„XеӨ§дәҺY
|
|
| 5. еҚ•йҖүйўҳ | |
|
дёӢеҲ—е®һйӘҢеҲҶзҰ»ж“ҚдҪңиғҪиҫҫеҲ°зӣ®зҡ„зҡ„жҳҜпјҲ пјү
A . з”ІпјҡеҲҶзҰ»зўҳеҚ•иҙЁе’Ңж°ҜеҢ–й“өзҡ„ж··еҗҲеӣәдҪ“
B . д№ҷпјҡеҲҶзҰ»зЎ«й…ёй’ЎеӣәдҪ“е’Ңж°ҜеҢ–й’ жә¶ж¶Ізҡ„ж··еҗҲзү©
C . дёҷпјҡеҲҶзҰ»д№ҷйҶҮе’Ңж°ҙзҡ„ж··еҗҲжә¶ж¶І
D . дёҒпјҡеҲҶзҰ»зЎқеҹәиӢҜе’ҢиӢҜзҡ„ж··еҗҲжә¶ж¶І
|
|
| 6. еҚ•йҖүйўҳ | |
|
еҢ–еӯҰеҸҚеә”еҺҹзҗҶжҳҜз ”з©¶еҢ–еӯҰзҡ„йҮҚиҰҒе·Ҙе…·пјҢдёӢеҲ—зӣёе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . CH4(g)пјӢCl2(g)
 CH3Cl(g)пјӢHCl(g)иғҪиҮӘеҸ‘иҝӣиЎҢпјҢеҲҷиҜҘеҸҚеә” CH3Cl(g)пјӢHCl(g)иғҪиҮӘеҸ‘иҝӣиЎҢпјҢеҲҷиҜҘеҸҚеә”  Hпјһ0
B . еҗ‘зўій…ёй’ жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸзҡ„ж°Ҝж°”пјҡNa2CO3пјӢH2OпјӢ2Cl2=2HClOпјӢ2NaClпјӢCO2
C . е®Өжё©дёӢпјҢзЁҖйҮҠ0.1 mol/Lзҡ„HClOжә¶ж¶ІпјҢжә¶ж¶Ідёӯc(ClO-)еҮҸе°Ҹ
D . еҗ‘зЎ«й…ёй’ЎжӮ¬жөҠж¶ІдёӯеҠ е…Ҙи¶ійҮҸйҘұе’Ңзўій…ёй’ жә¶ж¶ІпјҢжҢҜиҚЎиҝҮж»Өжҙ—ж¶ӨпјҢеҗ‘жІүж·ҖдёӯеҠ е…Ҙзӣҗй…ёжә¶ж¶Іжңүж°”дҪ“дә§з”ҹпјҢиҜҙжҳҺKsp(BaSO4)пјһKsp(BaCO3) Hпјһ0
B . еҗ‘зўій…ёй’ жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸзҡ„ж°Ҝж°”пјҡNa2CO3пјӢH2OпјӢ2Cl2=2HClOпјӢ2NaClпјӢCO2
C . е®Өжё©дёӢпјҢзЁҖйҮҠ0.1 mol/Lзҡ„HClOжә¶ж¶ІпјҢжә¶ж¶Ідёӯc(ClO-)еҮҸе°Ҹ
D . еҗ‘зЎ«й…ёй’ЎжӮ¬жөҠж¶ІдёӯеҠ е…Ҙи¶ійҮҸйҘұе’Ңзўій…ёй’ жә¶ж¶ІпјҢжҢҜиҚЎиҝҮж»Өжҙ—ж¶ӨпјҢеҗ‘жІүж·ҖдёӯеҠ е…Ҙзӣҗй…ёжә¶ж¶Іжңүж°”дҪ“дә§з”ҹпјҢиҜҙжҳҺKsp(BaSO4)пјһKsp(BaCO3)
|
|
| 7. еҚ•йҖүйўҳ | |
|
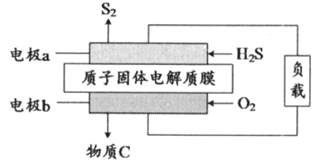
科еӯҰ家жңҖиҝ‘и®ҫи®ЎеҮәдәҶиҙЁеӯҗиҶңH2Sз”өжұ пјҢе®һзҺ°дәҶH2Sеәҹж°”еҸҳеәҹдёәе®қпјҢз”өжұ з»“жһ„еҺҹзҗҶеҰӮеӣҫпјҢдёӢеҲ—зӣёе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . з”өжһҒaдёәжӯЈжһҒпјҢеҸ‘з”ҹиҝҳеҺҹеҸҚеә”
B . HпјӢз»ҸиҝҮеӣәдҪ“з”өи§ЈиҙЁиҶңеҗ‘aз”өжһҒ移еҠЁ
C . з”өжһҒbзҡ„еҸҚеә”дёәпјҡO2пјӢ4e-пјӢ4HпјӢ=2H2O
D . з”ЁиҜҘз”өжұ иҝӣиЎҢзІ—й“ңзҡ„зІҫзӮјпјҢеҪ“з”өи·ҜдёӯиҪ¬з§»2 mol e-ж—¶пјҢйҳіжһҒеҮҸиҪ»64g
|
|
| 8. е®һйӘҢжҺўз©¶йўҳ | |||||||||||||||||
|
иӢҜиғәжҳҜдёҖз§ҚйҮҚиҰҒзІҫз»ҶеҢ–е·ҘеҺҹж–ҷпјҢеңЁжҹ“ж–ҷгҖҒеҢ»иҚҜзӯүиЎҢдёҡдёӯе…·жңүе№ҝжіӣзҡ„еә”з”ЁгҖӮе®һйӘҢе®Өд»ҘиӢҜдёәеҺҹж–ҷеҲ¶еҸ–иӢҜиғәпјҢе…¶еҺҹзҗҶз®ҖзӨәеҰӮдёӢпјҡ
е®һйӘҢжӯҘйӘӨпјҡ
|
|||||||||||||||||
| 9. з»јеҗҲйўҳ | |
|
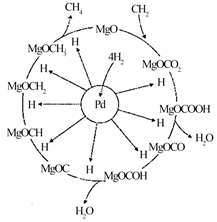
з”Ізғ·ж°ҙжұҪйҮҚж•ҙеҸҚеә”(SMR)жҳҜжҲ‘еӣҪдё»иҰҒзҡ„еҲ¶ж°ўжҠҖжңҜпјҢеҸҜд»ҘиҪ¬еҸҳжҲ‘еӣҪиғҪжәҗз»“жһ„пјҢеҠ©еҠӣжҲ‘еӣҪе®һзҺ°вҖңзўіиҫҫеі°вҖқзҡ„зӣ®ж ҮгҖӮSMRеҸҚеә”еёёдјҙйҡҸж°ҙз…Өж°”еҸҳжҚўеҸҚеә”(WGS)пјҡ
SMRпјҡCH4(g)пјӢH2O(g) WGSпјҡCO(g)пјӢH2O(g) еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 10. з»јеҗҲйўҳ | ||||||||||||||||
|
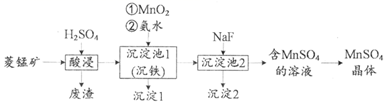
д»ҘиҸұй”°зҹҝ(дё»иҰҒжҲҗеҲҶдёәMnCO3 пјҢ иҝҳеҗ«жңүFe3O4гҖҒFeOгҖҒMgCO3зӯүжқӮиҙЁ)дёәеҺҹж–ҷеҲ¶еӨҮMnSO4зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢеӣҫпјҡ
е·ІзҹҘпјҡеёёжё©дёӢпјҢKsp(MnS)=1Г—10-11.йҮ‘еұһзҰ»еӯҗз”ҹжҲҗж°ўж°§еҢ–зү©жІүж·Җзҡ„pHеҰӮдёӢиЎЁпјҡ
|
||||||||||||||||
- жІіеҢ—зңҒеј е®¶еҸЈеёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёүжЁЎиҜ•еҚ·
- еұұдёңзңҒзғҹеҸ°еёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҜ•еҚ·
- ж№–еҢ—зңҒе…«еёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰ3жңҲжЁЎжӢҹиҜ•еҚ·
- зҰҸе»әзңҒеҚ—е№іеёӮжөҰеҹҺеҺҝ2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- ж№–еҢ—зңҒжӯҰжұүеёӮжӯҰжҳҢеҢә2020-2021еӯҰе№ҙй«ҳдәҢдёӢеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·
- жІіеҢ—зңҒйӮҜйғёеёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- еӨ©жҙҘеёӮж»Ёжө·ж–°еҢәеӨ§жёҜеӨӘе№іжқ‘дёӯеӯҰ2020-2021еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- й»‘йҫҷжұҹзңҒйҪҗйҪҗе“Ҳе°”еёӮдёүз«Ӣй«ҳзә§дёӯеӯҰ2021-2022еӯҰе№ҙй«ҳдёүдёҠеӯҰжңҹеҢ–еӯҰ第дёҖж¬ЎжңҲиҖғиҜ•еҚ·
- 2021й«ҳиҖғзңҹйўҳжұҮзј–-зү©иҙЁз»“жһ„дёҺжҖ§иҙЁ
- еұұдёңзңҒжғ ж°‘еҺҝ第дәҢдёӯеӯҰиҮҙиҝңйғЁ2020-2021еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰ10жңҲжңҲиҖғиҜ•еҚ·
- 2021е№ҙй«ҳиҖғеҢ–еӯҰзңҹйўҳиҜ•еҚ·пјҲеӨ©жҙҘеҚ·пјү
- е®үеҫҪзңҒж·®еҚ—еёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҜ•еҚ·пјҲ4жңҲпјү

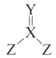


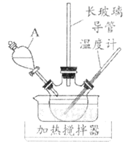



 гҖӮйҡҸж°ҙи’ёж°”еҲҶеҺӢ
гҖӮйҡҸж°ҙи’ёж°”еҲҶеҺӢ  зҡ„еҸҳеҢ–еҰӮдёӢеӣҫ1пјҢ
зҡ„еҸҳеҢ–еҰӮдёӢеӣҫ1пјҢ