河南省济源平顶山许昌2021年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-04-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
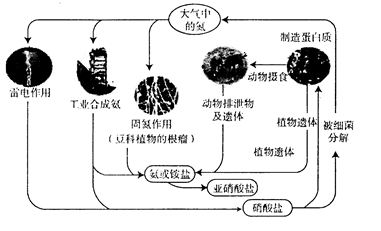
下列关于自然界中氮循环(如图)的说法错误的是( )
A . 自然界中,含氮有机物和含氮无机物之间可以相互转化
B . 氨与铵盐参与循环成为大气中的游离氮只发生氧化反应
C . 工业合成氨是氮肥工业的基础,氨也是重要的工业原料
D . 在自然界氮循环中,碳、氢、氧三种元素也参加了循环
|
|
| 2. 单选题 | |
|
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 0.3molFe与水蒸气发生反应转移电子数为0.9NA
B . 标准状况下2.24L氯气溶于水,反应转移的电子数为0.1NA
C . 17.6g丙烷中所含的极性共价键的个数为4NA
D . 5g质量分数为46%的乙醇所含氢原子数为0.6NA
|
|
| 3. 单选题 | |
|
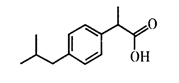
芬必得是一种高效的消炎药物,主要成分为化合物布洛芬,其结构简式如图所示,下列说法正确的是( )
A . 布洛芬可以发生加成、氧化、取代反应
B . 布洛芬不能使酸性高锰酸钾溶液褪色
C . 布洛芬的分子式为C12H18O2
D . 布洛芬苯环上的一氯取代产物有四种
|
|
| 4. 单选题 | |
|
为了测定M克含有少量氯化钠杂质的碳酸钠样品的纯度,可用下图装置进行实验(部分试剂 未标明),下列有关说法错误的是( )
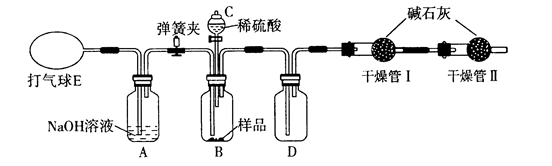
A . 实验前要通过E鼓入空气,排尽装置中的CO2
B . 实验中应先关闭弹簧夹,再向B中加入稀硫酸
C . 装置D中应装入足量NaOH溶液,充分吸收CO2
D . 干燥管Ⅱ的使用,提高了实验结果的准确性
|
|
| 5. 单选题 | |
|
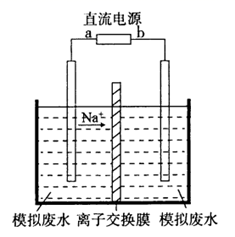
化纤工业中聚酯生产过程会产生大量的乙醛废水。隔膜电解法是处理高浓度乙醛废水的一种新方法,可让乙醛同时在阴、阳两极发生反应。实验室以一定浓度的CH3CHO-Na2SO4溶液为电解液,模拟乙醛废水处理 过程,工作原理如图所示。下列说法正确的是( )
[已知阴极区域反应主要过程可表示为:H2O+e- =H*+OH- 、CH3CHO+2H* = CH3CH2OH (H*为活泼H)]
A . 与b相连的极区发生反应:CH3CHO+H2O-2e- =CH3COOH+2H+
B . 在处理废水过程中阳极区域pH逐渐增大
C . 图中离子交换膜应该是阴离子交换膜
D . 电解过程中阴极可能发生副反应2H2O+2e-=H2↑+2OH-
|
|
| 6. 单选题 | |
|
W、X、Y、Z、M是原子序数依次增大的短周期主族元素。W元素的原子半径最小,X的氢化物可做制冷剂,Y的族序数等于周期数,Z元素最高价氧化物对应水化物是一种无色油状液体。 下列说法正确的是( )
A . 工业上用Y与M形成的化合物熔融电解制备单质Y
B . Z单质在空气中燃烧和在纯氧中燃烧生成的产物不同
C . W、X、Z形成的一种化合物能与盐酸或NaOH反应
D . M元素简单离子的半径是同周期主族元素形成简单离子半径最大的
|
|
| 7. 单选题 | |
|
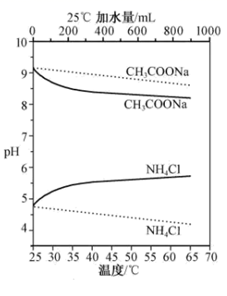
实验测得 10 mL 0. 50 mol•L -1NH4Cl溶液、10 mL 0. 50 mol•L -1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25℃时CH3COOH和NH3•H2O的电离常数均为1. 8×10-5.下列说法错误的是( )
A . 加水稀释初期两种盐的水解率变化程度比稀释后期大
B . 图中虚线表示pH随加水量的变化,实线表示pH随温度的变化
C . 将NH4Cl溶液加水稀释至浓度
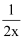 mol・L-1溶液pH变化值小于lgx
D . 将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH mol・L-1溶液pH变化值小于lgx
D . 将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH  ) )
|
|
| 8. 实验探究题 | |||||||||||||
|
碘是人类生命必需的微量元素,主要来源于海产品。某学习小组称取100
g海带(假设碘都以I-的形式存在),经过实验最后得到了碘的CCl4溶液。现将碘的CCl4溶液分成5等
份,进行分离碘和CCl4及测定碘含量的实验,四位同学查阅资料提出不同设计方案。资料显示:
①碘44℃开始升华; ②溶剂的沸点
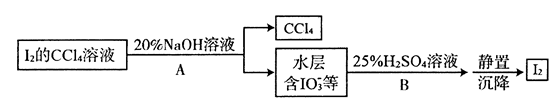
③2 Na2S2O3 + I2 = Na2S4O6 + 2NaI 方案实施如下:甲同学取其中1份混合溶液用普通蒸馏装置进行蒸馏,使四氯化碳和碘分离,结果所得溶液显紫色。 乙同学认为甲同学的萃取剂选的不合适,于是重新取海带做实验,在萃取碘单质时,用其他试剂代替四氯化碳进行萃取分液,然后再蒸馏,结果得到无色溶液。 丙同学取其中1份混合溶液按下列过程进行实验。 丁同学取1份碘的四氯化碳溶液于锥形瓶中,用C molA,Na2S2O3溶液进行滴定,重复操作 2次,平均消耗Na2S2O3 V mL。 根据上述四位同学实验回答下列问题:
|
|||||||||||||
| 9. 综合题 | |
|
钛铁铳矿可有效富集回收矿石中铁、钛、钪金属,获得铁精矿、钛精矿、钪精矿等主产品。从钛铁钪矿(主要成分有Sc2O3、FeTiO3、SiO2等)中制备草酸铳晶[Sc2(C2O4)3•5H2O]流程如下:
Sc(HA2)3•xH2O+xTBP ②常温下Sc(OH)3的Ksp约为1.0×10-31 请回答下列问题:
|
|
| 10. 综合题 | |
|
NOx的含量是空气质量的一个重要指标,减少NOx的排放有利于保护环境。
|
|
- 广东省梅州市梅州中学2019-2020学年高二下学期化学4月月考试卷
- 吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期化学期末考试试卷
- 黑龙江省佳木斯一中2019-2020学年高一上学期化学期末考试试卷
- 高中化学人教版(新课标)必修1 第四章第三节 硫和氮的氧化物
- 河南省驻马店市2019-2020学年高一下学期化学期末考试试卷
- 河南省郑州市2018-2019学年高一上学期化学期末考试试卷
- 2017年高考化学备考复习专题四:离子反应
- 辽宁省锦州市滨海新区2018-2019学年上学期11月-12月高一化学月考测试卷
- 黑龙江省海林市朝鲜族中学2019-2020学年高三上学期化学期末考试试卷
- 2016年宁夏银川市长庆高级中学高考化学一模试卷
- 吉林长春市榆树高级中学2019-2020学年高二下学期化学期末考试试卷
- 备考2018年高考化学一轮基础复习:专题27 化石燃料与有机化合物
 已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O
已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O  Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+3H+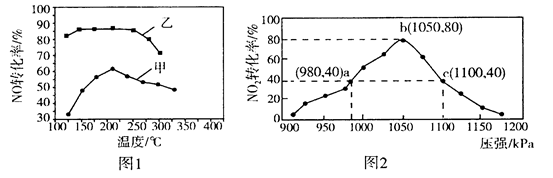
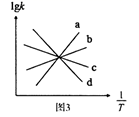
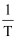 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随
表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随