备考2020年高考化学二轮专题 08 元素周期表和元素周期律
备考2020年高考化学二轮专题 08 元素周期表和元素周期律
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
氮、磷、砷
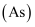 、锑 、锑  、铋 、铋 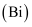 、镆 、镆  为元素周期表中原子序数依次增大的同族元素。回答下列问题: 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
|
|
| 2. 单选题 | |
|
化学学科中有很多的“规律”,下列规律运用正确的是( )
A . 酸性:H2CO3<H3PO4<H2SO4<HClO4 , 所以非金属性C<P<S<Cl
B . 依据强酸能制弱酸的原理,H2SO4能与CuS反应制取H2S
C . 任何方式下的氧化还原反应,氧化剂的氧化性一定强于氧化产物
D . 任何条件下,体积大的气体的物质的量一定比体积小的气体多
|
|
| 3. 单选题 | |
|
W、X、Y、Z为四种短周期主族元素,在光照条件下W的简单氢化物与氯气反应生成油状液体,X的气态氢化物的水溶液呈碱性,Y原子半径是短周期主族元素原子中最大的,Z2-的电子层结构与氩相同。下列说法错误的是( )
A . 简单氢化物的稳定性:W<X
B . Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
C . 工业上常用电解熔融Y的氯化物制取Y的单质
D . 简单离子半径:Z>X>Y
|
|
| 4. 单选题 | |
|
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A . 原子半径:Y>W
B . Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态
C . 最低价氢化物的沸点:W<Z
D . X的最高价氧化物的水化物既能与酸反应又能与碱反应
|
|
| 5. 单选题 | |
|
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2−具有相同的电子层结构;离子半径:Z2−>W−;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )
A . X、M两种元素只能形成X2M型化合物
B . 由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低
C . 元素X、Z、W的单质晶体中含相同类型的化学键
D . 元素W和M的某些单质可作为水处理中的消毒剂
|
|
| 6. 单选题 | |
|
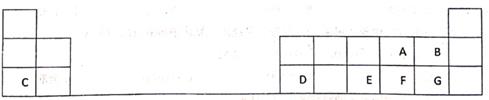
2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法错误的是( )
A . 最高价氧化物对应水化物的酸性:Z>Y
B . W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C . 在元素周期表中,117号元素与Z元素位于同一主族
D . 工业上常用YX2漂白纸浆、毛、丝等
|
|
| 7. 综合题 | |
|
X、Y、Z、M四种短周期元素,原子半径M>Z>X>Y,其中X、Y处在同一周期,X、Z处在同一主族。Z原子核内质子数等于X、Y原子核内质子数之和,原子核外最外层上的电子数是M原子核外最外层电子数的4倍。请回答:
|
|
| 8. 综合题 | |
|
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
|
|
| 9. 单选题 | |
|
请阅读下列材料,回答问题。
联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
|
|
| 10. 综合题 | |
|
已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
|
|
最近更新
 的中子数为。
的中子数为。 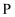 (
(  ,白磷)=
,白磷)=  ;
;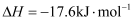 ;
;
 (填“>”“<”)。
(填“>”“<”)。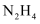
 (填“>”“<”),判断依据是。
(填“>”“<”),判断依据是。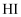 反应产物的推断正确的是(填序号)。
反应产物的推断正确的是(填序号)。  反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应 能发生较强烈的水解,生成难溶的
能发生较强烈的水解,生成难溶的 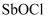 ,写出该反应的化学方程式,因此,配制
,写出该反应的化学方程式,因此,配制 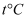 时发生如下反应:
时发生如下反应: ①
① ②
② ③
③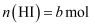 ,
, 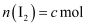 ,
, 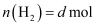 ,则
,则 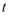 ℃时反应①的平衡常数
℃时反应①的平衡常数  值为(用字母表示)。
值为(用字母表示)。

 Md的质量数为( )
Md的质量数为( )



