四川省内江市2022届高三下学期第三次模拟考试题理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与社会、生产及生活密切相关。下列叙述正确的是( )
A . 油脂、糖类以及蛋白质在人体内均能发生水解反应
B . 自来水厂常用明矾、O3、ClO2等做水处理剂,其作用都是杀菌消毒
C . “北斗系统”装载高精度铷原子钟搭配铯原子钟,铷和铯属于同位素
D . 2022年北京冬奥会“飞扬”火炬喷口外壳采用聚硅氮烷树脂,该树脂属于高分子化合物
|
|
| 2. 单选题 | |
|
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 1 mol H2O2中含有极性共价键的数目为3NA
B . 25℃1 L pH=1的H3PO4溶液中H+数目为0.1NA
C . 20 g H218O含有的中子数为12NA
D . 足量铁粉与1 L14 mol/L浓硝酸加热充分反应转移电子数目为7NA
|
|
| 3. 单选题 | |||||||||||||||||||||
|
提纯下列物质(括号内物质为杂质)的方案中,不能达到目的的是( )
A . ①
B . ②
C . ③
D . ④
|
|||||||||||||||||||||
| 4. 单选题 | |
|
某药物的合成中间体R的结构如图所示,下列有关有机物R的说法错误的是( )
A . 其分子式为C13H12O4
B . 分子中所有碳原子可能共平面
C . 其苯环上的一氯代物有4种
D . 既能使溴水褪色,又能使酸性高锰酸钾溶液褪色
|
|
| 5. 单选题 | |
|
短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y,W原子序数为Y原子序数的2倍。下列叙述错误的是( )
A . 在同周期元素最高价氧化物对应水化物中,W的酸性最强
B . Z与Y可形成Z2Y、Z2Y2离子化合物
C . 热稳定性:X2W<X2Y
D . 常见简单离子半径:Z<Y<W
|
|
| 6. 单选题 | |
|
近日,我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是( )
A . 使用催化剂能有效减少副产物CO的生成;使用s-SnLi催化剂,中间产物更不稳定
B . 充电时,阳极电极周围pH降低
C . 放电时,每生成1 mol HCOO- , 转移1 mol电子
D . 放电时,负极电极反应式为Zn+4OH--2e-=

|
|
| 7. 单选题 | |
|
已知SrF2属于难溶于水、可溶于酸的强碱弱酸盐。常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中-1gc(X)(X为Sr2+或F-)与1g
 的关系如图所示。 的关系如图所示。
下列说法错误的是( )
A . L1代表-lgc(F-)与lg
 的变化曲线
B . Ksp(SrF2)的数量级为10-9
C . a、c两点的溶液中均存在:2c(Sr2+)=c(F-)+c(HF)+c(Cl-)
D . c点的溶液中存在c(Cl-)>c(Sr2+)=c(HF)>c(H+) 的变化曲线
B . Ksp(SrF2)的数量级为10-9
C . a、c两点的溶液中均存在:2c(Sr2+)=c(F-)+c(HF)+c(Cl-)
D . c点的溶液中存在c(Cl-)>c(Sr2+)=c(HF)>c(H+)
|
|
| 8. 实验探究题 | |
|
硫氰化钾(KSCN)是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某实验小组用下图所示的装置制备硫氰化钾。
已知CS2是一种难溶于水的无色液体,密度为1.26g/cm3 , NH3难溶于CS2。回答下列问题:
|
|
| 9. 综合题 | |
|
葡萄糖、葡萄糖酸在医疗和工业上有广泛用途。
|
|
| 10. 综合题 | |
|
研究二氧化碳的资源化利用具有重要的意义。回答下列问题:
|
|
- 江苏省扬州市2016-2017学年高一下学期化学期末考试试卷
- 2016-2017学年陕西省咸阳市百灵中学高三上学期期中化学试卷
- 2016-2017学年山东省淄博市桓台二中高二上学期期中化学试卷
- 第19讲:化学反应方向及化学平衡
- 上海市嘉定区2018-2019学年高三上学期化学一模考试试卷
- 2015-2016学年江西省宜春市高二上学期期末化学试卷
- 2016年高考理综真题试卷(化学部分)(新课标Ⅱ卷)
- 广东省深圳市2020年高考理综-化学线上模拟试卷(全国I卷)
- 2017年高考化学押题预测卷(新课标Ⅰ卷)
- 广东省汕头市2016-2017学年高三上学期化学期末考试试卷
- 陕西省榆林市2018-2019学年高考理综-化学模考试卷
- 2015-2016学年内蒙古巴彦淖尔市杭锦后旗奋斗中学高一下学期期末化学试卷




 NH4SCN+NH4HS。
NH4SCN+NH4HS。
 NH3↑+H2S↑),打开K2 , 继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为。
NH3↑+H2S↑),打开K2 , 继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为。
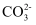 (aq)⇌PbCO3(s)+
(aq)⇌PbCO3(s)+ (aq),平衡常数K=(列出计算式)。
(aq),平衡常数K=(列出计算式)。


 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=kJ/mol。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是。
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=kJ/mol。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是。
 ]。该温度下,反应II的Kp(已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),用CH4的分压变化表示反应I在10分钟内达平衡的平均速率为MPa·min-1(列出算式即可)。
]。该温度下,反应II的Kp(已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),用CH4的分压变化表示反应I在10分钟内达平衡的平均速率为MPa·min-1(列出算式即可)。



