贵州省遵义市2022届高三下学期三模理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | ||||||||||||||||
|
化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 2. 单选题 | |
|
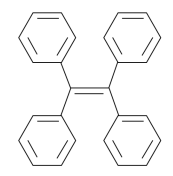
下列有关有机物的说法中,正确的是( )
A . 聚乙烯(
|
|
| 3. 单选题 | |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 0.1molI2与1molH2反应,生成HI分子数为0.2NA
B . 25℃时,1L0.2mol/LCH3COONH4溶液(pH=7)中,
 数为0.2NA
C . 标准状况下,11.2L苯中,含有0.5NA个苯分子
D . 20g 数为0.2NA
C . 标准状况下,11.2L苯中,含有0.5NA个苯分子
D . 20g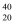 Ca2+含有的电子数为9NA Ca2+含有的电子数为9NA
|
|
| 4. 单选题 | |
|
已知常温时,0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A . 加水稀释H2A溶液,H2A的电离程度增大,溶液中各离子浓度均减小
B . 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)>c(HA-)
C . 在Na2A、NaHA两溶液中,离子种类不相同
D . 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
|
|
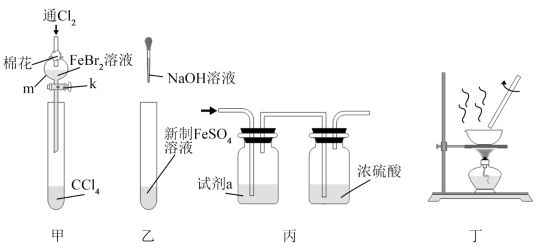
| 5. 单选题 | |||||||||||||||||||||
|
化学是一门以实验为基础的学科。下列所选试剂(或操作)和实验装置合理的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
a、b、c、d是原子序数依次增大的短周期元素,甲、乙、丙、丁、戊、己是由这四种元素组成的单质或化合物。它们之间有如下反应:①甲+乙→戊+己;②甲+丙→丁+己。已知己是由c元素形成的常见单质,常温时,0.01mol/L戊溶液的pH=12。下列说法中错误的是( )
A . b是第二周期元素
B . 甲中有非极性共价键,且1mol甲中含有4mol离子
C . 己在自然界中有同素异形体
D . c、d形成的简单离子,它们的电子层结构相同
|
|
| 7. 单选题 | |
|
利用电化学原理,模拟工业电解法来处理含
 的废水。如下图所示;电解过程中溶液发生反应: 的废水。如下图所示;电解过程中溶液发生反应: +6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法中错误的是( ) +6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法中错误的是( )
A . 石墨I极是负极
B . 当电路中有3mol电子转移时,Fe(I)极上有56g铁参与反应
C . 在反应前后甲装置中
 的数目不变
D . 石墨II极上的反应是:2N2O5+O2+4e-=4 的数目不变
D . 石墨II极上的反应是:2N2O5+O2+4e-=4
|
|
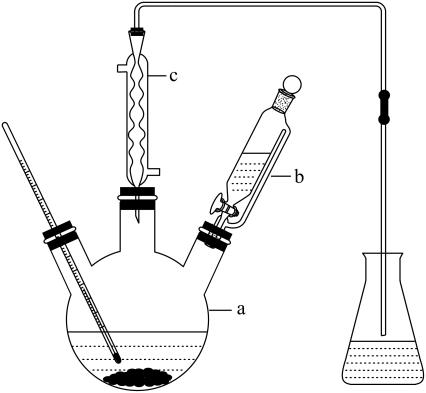
| 8. 实验探究题 | |||||||||||||||||
|
溴苯是一种重要的化工原料,可用作溶剂、汽车燃料、有机合成原料、合成医药农药、染料等。纯净的溴苯是一种无色透明的油状液体。其制备原理如下:
 +Br2 +Br2 实验操作:先将铁粉和苯加入反应器a(如图所示)中,在搅拌下缓慢加入液溴,于70-80℃保温反应数小时,得棕褐色液体。将棕褐色液体转移到分液漏斗中,依次用水洗、5%氢氧化钠溶液洗、水洗、干燥。过滤,最后经常压分馏,收集155-157℃馏分。相关物质有关数据如下:
请回答下列问题:
|
|||||||||||||||||
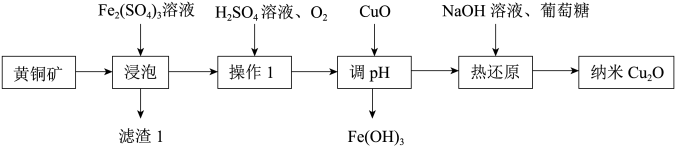
| 9. 综合题 | |
|
纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:
请回答下列问题:
|
|
| 10. 综合题 | |
|
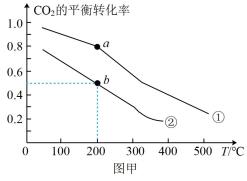
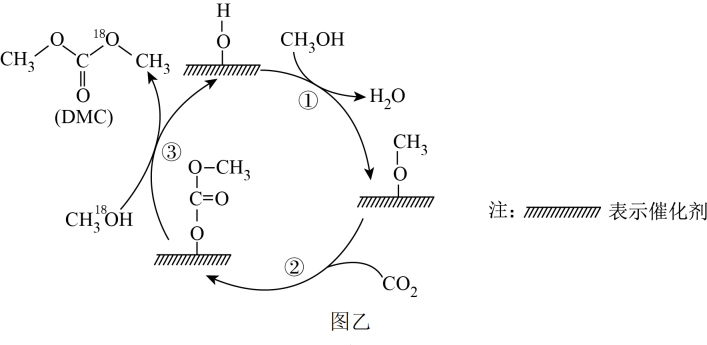
我国力争实现2030年前碳达峰、2060年前碳中和的目标,CO2的捕集、利用与封存成为科学家研究的重要课题。
|
|
- 2017年陕西省延安市黄陵中学重点班高考化学考前模拟试卷(二)
- 2018年高考化学真题分类汇编专题02:化学用语与化学基本概念
- 吉林省长春市农安县2019-2020学年高一下学期化学期末考试试卷
- 2016-2017学年黑龙江省哈尔滨市四校联考高一上学期期中化学试卷
- 2015-2016学年河南省信阳市明港一中高三下学期第一次月考化学试卷
- 陕西省咸阳市2020年高考理综-化学二模试卷
- 江苏省宿迁市2019-2020学年高二下学期化学期末考试试卷
- 安徽省蚌埠市田家炳中学、五中2019-2020学年高三上学期理综-化学期中考试试卷
- 浙江省绍兴市2020年高考化学联考模拟试卷
- 2015-2016学年浙江省湖州市高一下学期期末化学试卷
- 陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期化学第二次月考试卷
- 四川省广安市2017-2018学年高一下学期化学期末考试试卷

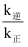 (填“增大”、“不变”或“减小”);若反应I在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是。
(填“增大”、“不变”或“减小”);若反应I在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是。