第1章 化学反应 知识点题库
物质 | X | Y | Z | Q |
反应前的质量/g | 2 | 2 | 84 | 5 |
反应后的质量/g | 待测 | 24 | 0 | 14 |
下列说法正确的是 ( )
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动小组想测定20g该品牌洁厕灵溶液中H2SO4和HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 |
(已知BaCl2溶液的pH=7;Ba的相对原子质量137)
求:20g该品牌洁厕灵溶液中H2SO4的质量和HCl的质量.

-
(1)
铁元素在地壳中主要以化合态存在,从铁矿石中冶炼出铁的主要反应如下:Fe2O3+3CO
 2Fe+3CO2该反应分解反应;(选填“是”或“不是”)
2Fe+3CO2该反应分解反应;(选填“是”或“不是”) -
(2) 已知锰(Mn)的金属活动性强于锌,不锈钢材料中锰若析出进入人体胃中,会与胃液中的盐酸发生置换反应,反应产物中锰元素化合价+2价,请写出该反应的化学方程式;
-
(3)
已知碳、铁和硅等单质能发生以下反应:①C+O2
 CO2 ②Fe+2HCl═FeCl2+H2↑ ③Si+2NaOH+H2O═Na2SiO3+2H2↑
CO2 ②Fe+2HCl═FeCl2+H2↑ ③Si+2NaOH+H2O═Na2SiO3+2H2↑请从反应前与反应后元素化合价改变的角度,归纳出3个反应的共同规律.

-
(1) 蔗糖(C12H22O11)在酶的催化作用下与水作用只生成葡萄糖(C6H12O6 ),反应中氢、氧元素的原子个数比是.
-
(2) 琥珀酸亚铁的相对分子质量为,成人每日1片速力菲,每日的补铁量为 g.
-
(3) 硫酸亚铁与另一种物质发生反应可制得琥珀酸亚铁,则另一种物质中必有元素.
物质 | a | b | c | d |
反应前质量(g) | 6.4 | 3.2 | 4.0 | 0.5 |
反应后质量(g) | 待测 | 2.56 | 7.2 | 0.5 |
下列说法中错误的是( )
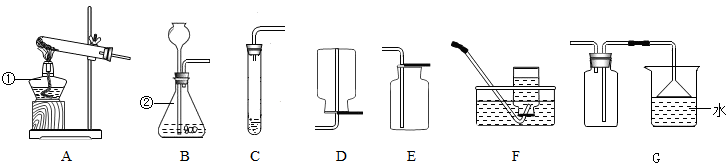
-
(1) 写出图中仪器①、②的名称:①;②。
-
(2) 实验室用高锰酸钾制取氧气,可选用的气体发生装置为 (填字母,下同),气体收集装置为或;该装置中,固定仪器时的一条主要注意事项是。
-
(3) 实验室用高锰酸钾制取氧气时,试管口处要 。
-
(4) 实验室加热高锰酸钾制取氧气(用排水法收集)的主要步骤有:①装入药品;②检查装置气密性;③收集气体;④加热;⑤停止加热;⑥移出导气管。正确的操作顺序为A . ①②③④⑤⑥ B . ②①③④⑥⑤ C . ②①④③⑤⑥ D . ②①④③⑥⑤
-
(5) 若使用B装置来进行二氧化锰和过氧化氢制取氧气的实验,在该反应中二氧化锰是;该反应的文字表达式为。
-
(6) 经查资料可知,NH3的密度比空气小,极易溶于水,有刺激性气味。实验室常用加热氯化铵和氢氧化钙固体的方法来制取NH3 , 选用装置作制取氨气的发生装置,最好选用装置来收集NH3 , 理由是


-
(1) 将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水g。
-
(2) 样品中氢氧化钠的质量分数。
-
(3) 反应后所得溶液中溶质的质量分数。
-
(1) 该转化属于(填“物理”或“化学”)变化;其催化剂是两种(填“金属”或“非金属”)。
-
(2) 在能源领域,一氧化碳是液态氢的一种重要补充物,液态氢是一种(填“化石能源”或“清洁能源”)。
-
(3) 甲醇(CH4O)可用作赛车燃料,在空气中完全燃烧生成二氧化碳和水,则化学方程式为 。
-
(1) 反应后得到滤液,其质量(选填“小于”、“大于”或“等于”)反应前所取废液样品的质量。
-
(2) 若反应后得到的滤渣中有镁粉,则滤渣中除镁粉外还含有(填写化学式)。
材料一:1673年,英国化学家波义耳将某金属放在一个密闭容器中煅烧,煅烧后立即打开容器进行称量,结果发现煅烧后的固体质量增加了。
材料二:1774年,拉瓦锡用精确的定量实验研究在密封容器中氧化汞分解前的质量和分解后生成物的总质量之间的关系,证实了质量守恒定律。
请回答以下问题:
-
(1) 小明认为波义耳实验也符合质量守恒定律,理由是。
-
(2) 小明采用图甲实验方案,测量酒精和水混合前后质量是否相等来验证质量守恒定律,老师看到后直接否定该方案,理由是。

-
(3) 小明决定用如图乙装置模拟拉瓦锡实验,测定反应前氧化汞的质量和应后生成物的总质量是否相等来验证质量守恒定律。小明记录了以下几组数据:(已知:氧的密度为ρ克/毫升,氧化汞分解的化学方程式:2HgO=2Hg+O2↑)
①反应前称取的氧化汞质量a克 ②反应前装有氧化汞试管的总质量b克
③反应结束冷却后试管的总质量c克 ⑤反应前量筒的总质量e克
④反应后量筒内增加的水体积d毫升 ⑥反应结束后量筒和水的总质量f克
实验操作均正确,在误差范围内,如果出现等量关系(用上述字母表示),可用来验证质量守恒定律。

-
(1) 实验室收集一瓶氧气可选择的装置是。
-
(2) 实验室制氧气的发生装置可以选用A装置,选择A装置的依据是。

-
(1) 配制18%的稀盐酸100 g,需要这种浓盐酸的体积约为mL(保留一位小数)
-
(2) 某同学想测试一包含有杂质的碳酸钙固体的纯度,取该固体8 g,加入以上配制的质量分数为18%的盐酸至不再产生气泡为止,共生成气体的质量为2.2 g,试计算该包固体中所含碳酸钙的质量分数? (可能用到的相对原子质量:H-1、C-12、O-16、Ca-40、Cl-35.5)
实验一:加热氯酸钾和二氧化锰制取氧气,完全反应后停止加热,得到固体残留物A。
实验二:往铁粉中滴加一定量的稀盐酸,充分反应后,得到混合物B。
实验三:加热铜粉测定空气中的氧气含量,实验结束后得到黑色固体化合物C。

-
(1) 在进行实验一时,发现试管固定得太高,可调节上图中的旋钮。
-
(2) 通过实验二,可以验证酸的一项通性,即酸能和活泼金属反应,生成。
-
(3) 实验三中,固体全为黑色,说明铜粉的量可能不足。若铜粉的量不足,据此测出的氧气体积分数与实际值相比会 (选填“偏小”、“偏大”或“相等” )。
-
(4) 利用上述三个实验后的剩余物质,继续进行如右图操作,发现加入盐酸时有气泡产生。已知二氧化锰不与稀盐酸反应。若不考虑溶液饱和导致晶体析出,请写出滤渣E中所有物质的化学式:。

|
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
|
|
第 1 次 |
40 |
m |
|
第 2 次 |
40 |
14.8 |
|
第 3 次 |
40 |
12.2 |
|
第 4 次 |
40 |
11.2 |
|
第 5 次 |
40 |
11.2 |
试回答下列问题:
-
(1) 从以上数据可知,最后剩余的11.2g固体的成分是;表格中,m=.
-
(2) 黄铜样品中锌的质量分数为.
-
(3) 计算所用稀硫酸中硫酸的质量分数是多少?



