课题1 生活中常见的盐 知识点题库
-
(1) 通过晾晒海水,可以蒸发除去水分,得到粗盐。通常不采用降低海水温度的方法得到粗盐,是因为,相同情况下降温析出的晶体比较少。
-
(2) 根据“粗盐中难溶性杂质的去除”实验,回答有关问题。
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.1g。
②过滤
③蒸发 在加热过程中,用玻璃棒不断搅拌,防止。当蒸发皿中,停止加热。
④计算产率 得到精盐3.3g,则精盐的产率为(计算结果保留一位小数)。
-
(3) 若经过上述实验得到的精盐中还含有氯化镁、氯化钙,为了除去这两种可溶性杂质,可将得到的精盐全部溶于水,加入过量的氢氧化钠溶液和溶液,充分反应后,接下来的操作顺序是(填序号)。
①蒸发 ②加入过量的稀盐酸 ③过滤
| 选项 | 需区分的物质 | 方法1 | 方法2 |
| A | 过氧化氢溶液和水 | 分别加入二氧化锰,观察现象 | 取样,分别加入硫酸铜溶液,观察现象 |
| B | 铁粉和木炭 | 取样,分别用磁铁吸引,观察现象 | 取样,分别加稀硫酸,观察现象 |
| C | 酒精和醋酸 | 闻气味 | 取样,分别滴无色酚酞溶液,观察现象 |
| D | 硬水和蒸馏水 | 分别取样,蒸干观察 | 分别取样,加入等质量的 肥皂水搅拌,观察现象 |

图1 
图2 
A烧杯中一定发生的化学反应方程式为;B烧杯中滤液一定不含的离子是,小组同学对C烧杯中溶液的成分产生了兴趣,进行了下面探究。
(提出问题)c烧杯溶液的溶质中含有什么离子?(不考虑酚酞)
(猜想与假设)
甲猜想:H+、SO42-和Cl-
乙猜想:H+和Cl-
丙猜想:H+、SO42-、Cl-和Ba2+
丁猜想:Ba2+和Cl-
(表达与交流)丁同学认为上述的猜想一定错误,丁同学认为自己的猜想是正确的。
(活动与探究)丁同学为了证明自己的猜想,用试管取少量C中溶液,做如图实验,根据观察到的现象得出自己猜想成立的结论。请你对他的结论做出评价。
甲同学继续了丁同学的实验,他继续向试管中加入一种试剂,观察到了明显的实验的现象。
得出结论:丁同学猜想错误,甲同学加入的试剂可能是,通过以上实验探究你认为溶液中含有的离子为。
(总结与反思)通过上述探究过程可知,在分析和探究反应后溶液中离子成分时,首先可根据来推断出:不参与反应的离子一定存在,然后加入适当的试剂是否存在,才能得出正确结论。
方案一:称取mg烧碱样品  测定消耗稀盐酸的质量。
测定消耗稀盐酸的质量。
方案二:称取mg烧碱样品  测定生成沉淀的质量。
测定生成沉淀的质量。
请回答:
-
(1) 方案一中发生反应的化学方程式为。
-
(2) 方案一中为减少误差,最好选择下列方法中的______。(填字母)来判断反应恰好完全进行。A . 向样品溶液中滴加2~3滴无色酚酞溶液,根据溶液颜色变化判断. B . 测定过程中边滴加稀盐酸边用pH试纸频繁测定混合液的pH C . 向样品溶液中滴加2~3滴紫色石蕊溶液,根据颜色变化判断。
-
(3) 小李同学认为判断方案二中,氯化铁FeCl3溶液过量的化学方法是。
-
(4) 小李同学可将方案二中的FeCl3溶液换成稀硝酸和(填化学式)溶液也能达到实验的目的。
-
(1) 请写出操作②中加入Na2CO3溶液后,生成沉淀的化学式;
-
(2) 操作④中加入适量盐酸的目的是什么?
-
(3) 操作④中若加入过量盐酸也不会影响精盐的纯度,为什么?

-
(1) 写出下列物质的化学式。
B、C、D、G、
-
(2) 写出下列反应的文字表达式并注明反应的基本类型。
加热E和B的混合物反应类型( )。
H和A反应反应类型()。
-
(1)
-
(2)
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别硬水和软水 | 分别加入肥皂水,振荡 |
| B | 鉴别氧气、氮气、空气 | 分别伸入燃着的木条 |
| C | 除去二氧化碳中的一氧化碳 | 将气体通入足量氢氧化钠溶液 |
| D | 验证Mg、Fe、Cu活动性顺序 | 铁丝分别插入氯化镁和氯化铜溶液中 |
![]()
请回答下列问题:
-
(1) 写出A在空气中燃烧的主要现象:,放出大量的热。
-
(2) 写出B→A的化学方程式:,其基本反应类型为。
| 选项 | 实验目的 | 实验设计 |
| A | 除去硫酸亚铁溶液中的硫酸铜 | 加过量铁粉、过滤 |
| B | 鉴别氮气和二氧化碳 | 用燃着的木条,观察是否熄灭 |
| C | 鉴别硝酸铵固体和氢氧化钠固体 | 加水、溶解、测温度 |
| D | 黄铜和黄金 | 滴加适量稀盐酸,观察现象 |
| 选项 | 实验目的 | 实验方案 |
| A | 检验氯化钠溶液中含有盐酸 | 取样,滴加紫色石蕊试液,观察现象 |
| B | 鉴别化肥CO(NH2)2和NH4NO3 | 取样,加Ca(OH)2固体混合研磨,闻气味 |
| C | 分离MnO2和KCl的混合物 | 溶解、过滤、洗涤固体并烘干,蒸发滤液 |
| D | 除去NaOH溶液中的Na2CO3 | 加入适量的CaCl2溶液,过滤 |
 、
、  、
、  B .
B . 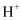 、
、  、
、  C .
C .  、
、 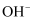 、
、  D .
D .  、
、  、
、 
-
(1) (实验活动1)

(观察与讨论)此滴加过程中,甲试管里发生反应的化学方程式为,乙试管中观察到,从而可以说明两种物质已经发生了反应。
-
(2) (实验活动2)先将甲实验废液倒入废液缸后,再将乙实验废液沿废液缸内壁缓慢倾倒,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。为了科学处理废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究。
(提出问题)最终废液中含有哪些离子?
(猜想与假设)甲同学猜想:Na+、Cl-
乙同学猜想:Na+、Cl-、

丙同学猜想:Na+、Cl-、
 、Ca2+
、Ca2+你的猜想是。
-
(3) (讨论与交流)经过大家讨论,一致认为丙同学的猜想是错误的,理由是。
-
(4) (活动与探究)为了验证猜想,同学们进行了如下实验:
取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。得出结论:则乙同学猜想成立。
(深入交流)甲、乙两个实验废液混合时,溶液中离子的数目变化趋势曲线如图所示,曲线a可以表示(填离子符号),曲线b可以表示(填离子符号)。

-
(5) (总结与交流)通过上述探究过程,同学们总结出在确定溶液混合后溶质成分时,往往要结合先确定一定含有的离子,才能使后续的实验简单明了,从而快速准确的得出正确的结论。
| 选项 | 鉴别方法 | 实验现象 | |
| CO | CO2 | ||
| A | 将气体分别通入澄清石灰水中 | 没有明显现象 | 石灰水变浑浊 |
| B | 将水分别注入充满待鉴别气体的塑料瓶中,迅速旋紧瓶盖,振荡 | 塑料瓶凹扁了 | 没有明显现象 |
| C | 将燃着的木条伸入集气瓶中 | 被点燃 | 木条熄灭 |
| D | 将气体分别通过灼热的氧化铜 | 黑色粉末变红色 | 没有明显现象 |

-
(1) 步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的(填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是。
A.①Ca(OH)2 ②Na2CO3 B.①Na2CO3 ②Ca(OH)2
C.①KOH ②Na2CO3 D.①NaOH ②Na2CO3
-
(2) 步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是,写出步骤Ⅲ反应的化学方程式。
-
(3) 步骤Ⅳ发生的反应属于反应(填基本反应类型)。
-
(4) 我国化学家侯德榜创立的联合制碱法的优点有____。A . 无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境 B . 大大提高了食盐的利用率,节约了成本 C . 将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥



