3.2 溶液 知识点题库
下列说法中,正确的是( )
A . 汽油可以乳化油污
B . 溶液都是无色透明的液体
C . 溶质都以离子形式溶解在溶剂里
D . 硝酸铵溶于水,使溶液的温度降低
下列判断正确的是( )
A . 合金至少由两种金属熔合而成
B . 不同种元素最本质的区别是质子数不同
C . 饱和溶液变成不饱和溶液,其溶质质量分数一定变小
D . 两种化合物相互作用生成另外两种化合物的反应一定是复分解反应
把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A . 甜面酱
B . 豆奶粉
C . 白砂糖
D . 花生油
如图是超市里一种盐汽水的营养成分表。
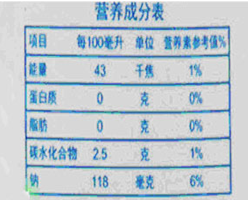
-
(1) 该汽水中能量很低,主要由____提供。该汽水中含人体每天所需的六大营养素有种。
-
(2) “钠118毫克”是指(填“单质”或“元素”)的质量;100mL汽水中含氯化钠毫克。
-
(3) 小虎同学欲探究该盐汽水的酸碱性,取少量汽水于试管中,滴加紫色石蕊试液,石蕊试液变红色,则该汽水显性,经查阅资料该汽水中溶有大量的CO2 , 要提高100mL水中CO2的溶解量,可、(写两种方法即可)。要证明盐汽水中含CO2 , 可用的方法检验CO2的存在。
将12.5g石灰石(杂质不与酸反应也不溶于水),加入到装有100g稀盐酸的烧杯中。恰好完全反应后,烧杯中物质的总质量为108.1g。请计算。
-
(1) 生成二氧化碳的质量为g。
-
(2) 求稀盐酸中溶质的质量分数(写出计算过程)。
某花卉基地配制180g20%的硝酸铵溶液,将此溶液平均分成两份,进行如下操作,请计算所得溶液的溶质质量分数。(只填计算结果)
-
(1) 加入10g硝酸铵,完全溶解:;
-
(2) 加入10g,30%的硝酸铵溶液: 。
如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述正确的是( )

A . t1℃时,等质量的甲、乙溶液中所含溶质的质量为乙>甲
B . t2℃时,20g丙能溶解于50g水中形成70g溶液
C . 若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D . t3℃时,将甲、乙、丙三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为甲=丙
将等质量的甲、乙两种固体分别加入到等质量t0℃的水中充分溶解后均有固体剩余,升高温度到t3℃剩余固体质量随温度的变化情况如图。下列说法错误的是( )
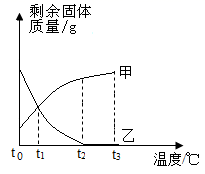
A . t2℃时,甲、乙两种物质的溶解度甲>乙
B . t3℃时,甲是饱和溶液
C . t0℃~t2℃乙物质的溶解度随温度升高而增大
D . 将温度从t2℃降至t1℃时,甲、乙两溶液的溶质质量分数相等
把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A . 碘
B . 汽油
C . 高锰酸钾
D . 面粉
黄铜是由铜、锌单质组成的合金,某企业要求含锌量介于25%~35%的黄铜属于合格品。现取黄铜样品10g,逐滴加入溶质质量分数为9.8%的稀硫酸至恰好完全反应生成气体的质量为0.1g。求:
-
(1) 该黄铜样品中锌的质量分数是否满足企业需要。
-
(2) 将反应后的溶液蒸发掉12.9g水没有晶体析出,求所得溶液中溶质质量分数。
甲、乙两种固体的溶解度曲线如图所示,下列说法错误的是( )
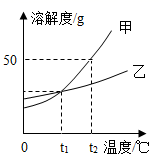
A . 甲的溶解度大于乙的溶解度
B . t1℃时,甲、乙饱和溶液中溶质的质量分数相等
C . 常采用冷却热饱和溶液的方法从溶液中获得甲物质晶体
D . 将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲等于乙
物质a、b、c的溶解度曲线如图所示,下列说法正确的是()
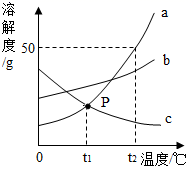
A.t2℃时a、b溶液降温至t1℃,a析出的晶体更多
B.t2℃时50gb加入100g水中得到饱和溶液
C.t2℃时c的饱和溶液降温至t1℃仍为饱和溶液
D.从含有少量c的溶液中提纯物质a可采用方法较好
甲、乙、丙三种物质的溶解度线如图所示,请回答问题。
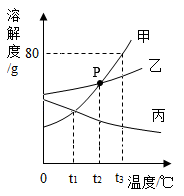
-
(1) 当温度为t2℃时,p点的意义,甲、乙、丙三种物质形成饱和溶液的溶质质量分数的关系为。
-
(2) t3℃时,甲的饱和溶液中溶质与溶液的质量比是(填最简比)。
-
(3) 若将丙的饱和溶液从t3℃降温到t1℃时,一定会发生改变的是。
A 溶解度 B 溶剂质量 C 溶质质量 D 溶质质量分数
母亲生日到了,小华为母亲准备了一束鲜花,并亲手烹调了一桌饭菜。
-
(1) 小华不小心将白醋滴在花瓣上,发现花的颜色由紫色变为红色,此过程发生了(填“物理变化”或“化学变化”)。
-
(2) 小华准备的饭菜有清蒸鲈鱼、凉拌黄瓜、蛋炒青笋、米饭和无糖可乐,其中富含糖类的是。
-
(3) 吃完饭,小华用洗涤剂去除餐具上的油污,是利用了洗涤剂能与油污发生(填“溶解作用”“乳化作用”或“化学反应”)。
-
(4) 将垃圾分类回收,能保护环境,节约资源。可乐瓶属于______(填字母)。A . 可回收垃圾 B . 有害垃圾 C . 厨余垃圾 D . 其他垃圾
将80g甲物质加入到50g的水中,充分溶解后所得溶液的质量与温度变化之间的关系如图所示,下列说法正确的是( )
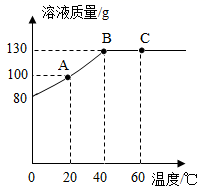
A . 40℃时甲物质的溶解度是130g
B . B、C点对应的甲溶液的溶质质量分数不同
C . A点对应的溶液中溶质和溶剂的质量比为1:1
D . 将60℃时对应的甲溶液降温到20℃,溶液中会有50g甲物质析出
下列图像分别表示实验过程中某些物理量的变化,其中正确的是( )
A . 用红磷燃烧的方法测量空气中氧气的含量  B . 加热氯酸钾和二氧化锰的混合物制备氧气
B . 加热氯酸钾和二氧化锰的混合物制备氧气  C . 向pH=1的盐酸中逐滴加入pH=13的氢氧化钠溶液
C . 向pH=1的盐酸中逐滴加入pH=13的氢氧化钠溶液 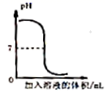 D . 在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
D . 在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体 
 B . 加热氯酸钾和二氧化锰的混合物制备氧气
B . 加热氯酸钾和二氧化锰的混合物制备氧气  C . 向pH=1的盐酸中逐滴加入pH=13的氢氧化钠溶液
C . 向pH=1的盐酸中逐滴加入pH=13的氢氧化钠溶液  D . 在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
D . 在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体 
华雪想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液。请回答下列问题:
-
(1) 若用氢氧化钠固体配制,需称取氢氧化钠g。
-
(2) 若华雪想用25%的氢氧化钠溶液稀释成此溶液,则她需要25%的氢氧化钠溶液g;需要蒸馏水g;应选用mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。
同学们在一定温度下进行KNO3的溶解实验,实验数据如下。根据数据分析,下列叙述正确的是( )
| 实验序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 水的质量(g) | 100 | 100 | 100 | 100 |
| 加入KNO3的质量(g) | 80 | 100 | 120 | 140 |
| 溶液质量(g) | 180 | 200 | 210 | 210 |
A . 实验1所得溶液的溶质质量分数= 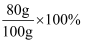 B . 实验2所得溶液为饱和溶液
C . 实验4所得溶液的溶质质量分数比实验3大
D . 该温度下,KNO3饱和溶液的溶质质量分数=
B . 实验2所得溶液为饱和溶液
C . 实验4所得溶液的溶质质量分数比实验3大
D . 该温度下,KNO3饱和溶液的溶质质量分数= 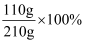
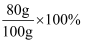 B . 实验2所得溶液为饱和溶液
C . 实验4所得溶液的溶质质量分数比实验3大
D . 该温度下,KNO3饱和溶液的溶质质量分数=
B . 实验2所得溶液为饱和溶液
C . 实验4所得溶液的溶质质量分数比实验3大
D . 该温度下,KNO3饱和溶液的溶质质量分数= 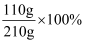
科学与人体健康。
-
(1) 人体能够把摄取的含大量淀粉的米饭和馒头等非甜味食品经过消化吸收产生大量葡萄糖。因此,为防止血糖升高,糖尿病人在饮食上要对米饭和馒头等非甜味食品摄入量进行。
-
(2) 生水中大肠杆菌往往含量超标,喝生水容易出现腹泻。生活中人们常用方式,消除去大肠杆菌。
-
(3) 正常胃液的pH为0.9-1.8.若pH<0.9为酸度过高,pH3.5-7.0为低酸,pH>7.0为无酸。某同学胃酸(主要成分为盐酸)pH=0.07,中医可用一种墨鱼骨粉【主要成分为CaCO3】治疗无溃疡型的过多胃酸,其原理是(用化学方程式表示)。
-
(4) 如图是医用生理盐水的部分标签。配制一瓶0.9%500ml生理盐水(生理盐水的密度近似按1g/ml),需要20%的氯化钠溶液的质量是 。

如图是Ca(OH)2的溶解度曲线,下列说法正确的是( )

A . 30℃时,向50g水中加入0.15gCa(OH)2后充分搅拌,可得到50.15g溶液
B . 将a点的溶液从30℃升温到70℃时溶质的质量分数变小
C . 将b点的溶液从70℃降温到30℃,有固体析出
D . 70℃时,饱和石灰水中溶质和溶液的质量比为0.1:100
最近更新



