4.4 化学方程式 知识点题库
①该大理石中碳酸钙的物质的量。(根据化学方程式列式计算)
②该大理石中碳酸钙的质量分数。
-
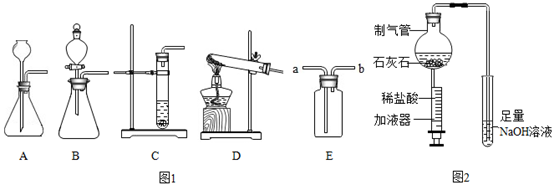
(1) 如图是实验室中制取气体常用到的仪器,请回答下列问题:
①请写出用D装置制取氧气的化学方程式:。
②实验室可用碳化钙(CaC2)固体和水反应来制取乙炔(C2H2)气体,该反应必须严格控制加水的速率,以免剧烈反应放热引起发生装置炸裂,则制取乙炔的最适合发生装置是;若用E装置采用排水法来收集乙炔,请简述操作步骤。
-
(2) 某化学兴趣小组设计了如图所示的微型实验。
①在制气管中加入碳酸钙,推压加液器活塞加入适量稀盐酸,请用化学方程式表示其反应原理。
②当制气管中的反应停止后,试管中溶液倒吸进制气管中,请解释产生上述现象可能的原因。
③如何检验试管中剩余溶液还有氢氧化钠?请简要写出实验步骤、现象和结论。
-
(3) 乙炔(C2H2)是一种重要的化工原料,常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙。若要制取7.8g乙炔气体,理论上需要碳化钙的质量是多少?
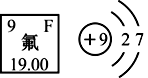
-
(1) 氟的相对原子质量是。
-
(2) 氟属于(填“金属”或“非金属”)元素。
-
(3) 氟原子在化学反应中容易电子(填“得到”或“失去”)。
-
(4) 用化学符号表示:① 2个氟离子; ② 氟化钙。
-
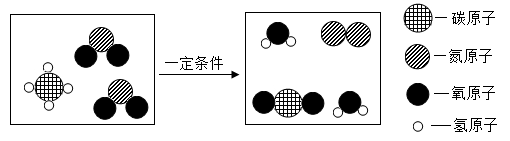
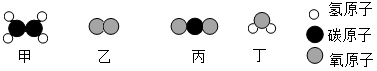
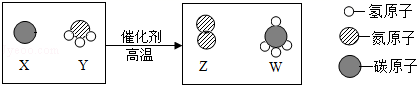
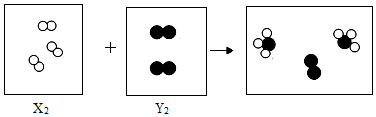
(5) 氟气与氢气在点燃时反应生成氟化氢,下图是该反应的微观示意图。
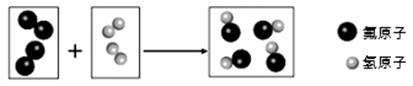
①该反应的符号表达式为。
②氟气的化学式为。
③从图中可认识到,在化学反应中,分子与原子的区别是:。
![]()
-
(1) 甲烷在空气中燃烧的化学方程式为。
-
(2) 可燃冰燃烧主要是将化学能转化为能。
-
(3) 甲烷不充分燃烧会生成、二氧化碳和水:要使其充分燃烧,你的做法是。
-
(4) 可燃冰 (填“属于”或“不属于”)新能源:目前人们正在利用和开发的新能源还有(填一种即可)。
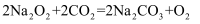 )
)
-
(1) 海水中含有较多的硫酸钠。硫酸钠是制造纸浆、燃料稀释剂,医药用品等的重要原料。某硫酸钠粗品中含有少量的硫酸钙、硫酸镁,实验室进行提纯的流程如下:
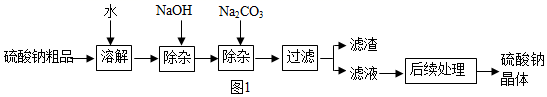
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为。
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量溶液除去。
③“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至(填序号)。
A 完全蒸干时停止加热
B 有大量固体析出时停止加热,利用余热蒸干
C 有大量固体析出时停止加热,过滤弃去剩余的少量溶液
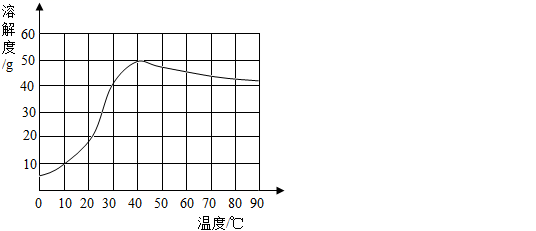
④已知硫酸钠的溶解度随温度变化的曲线如图6所示。40℃时,硫酸钠的溶解度为。将40℃时的该饱和溶液升高温度至90℃,观察到的现象是。
-
(2) 利用苦卤制取镁,主要流程如图:

步骤II中的试剂a是。步骤III中反应的化学方程式是。
-
(3) 采用氨碱法生产纯碱,主要流程如图:

①上述I、II两个步骤总反应的化学方程式是。
②从步骤Ⅱ过滤后得到碳酸氢钠,近日,一则《重大突破!癌细胞,竟被中国医生用小苏打“饿”死了》的新闻在网络上热传:研究人员用小苏打来去除肿瘤内的氢离子,就可破坏乳酸根和氢离子的协同作用,从而快速有效地杀死处于葡萄糖饥饿或缺乏的肿瘤细胞。请你用一个化学反应证明该研究成果的科学性(用化学方程式表示)。当然,科学原理如何转换到临床上来,还会是一个很难的跨越。
③最后得到的纯碱中若含有少量小苏打,应怎样除去?请写出所用方法或试剂。
-
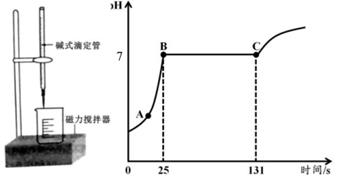
(1) 图中,A 点溶液中的溶质是.(填化学式)。
-
(2) 请计算该溶液中氯化钙的质量分数(写出计算过程,精确到 0.1%)。
-
(3) 图中 BC 段越长说明该溶液中氯化钙的质量分数越((填“大”或“小”)。
-
(1) CH3OH中C、H、O元素的质量比为。
-
(2) CH3OH中氢元素的质量分数是。
-
(3) 用CO和H2制备CH3OH时,若消耗了5.6kgCO,请计算生成的甲醇的质量。(写出计算过程)
|
石灰石样品质量 |
烧杯和稀盐酸的总质量 |
反应后烧杯及烧杯中各物质总质量 |
|
20g |
140g |
153.4g |
请计算:
-
(1) 碳酸钙中钙元素的质量分数。
-
(2) 样品中CaCO3的质量分数。

-
(1) 所标物质中属于金属单质的是。
-
(2) 夏天铜螺丝部位常出现一层绿色物质,这是由于铜生锈的原因,请完成该反应的化学方程式:
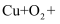
 。
。
-
(3) 该款变色眼镜的玻璃里加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银生成溴和银,玻璃颜色变深,此反应类型属于反应;当光线变暗时,溴和银在氧化铜作用下,重新生成溴化银,玻璃颜色变浅,氧化铜在反应中起作用。
-
(1) Cu+O2
 CuO
CuO
-
(2) C3H8+O2
 CO2+H2O
CO2+H2O
-
(3) FeS2+O2
 Fe2O3+SO2
Fe2O3+SO2

-
(1) 图中属于有机合成材料的是 (填一种);
-
(2) 较活泼的金属钠着火时不能使用二氧化碳灭火器,因为钠在二氧化碳气体中可以燃烧生成碳酸钠和一种黑色单质,请写出化学方程式: ;



