第五单元 化学方程式 知识点题库
化学与科技帮助人类实现“上九天揽月,下五洋采冰“。我国“天舟一号”“天宫二号”空间实验室首次成功交会对接。如图1是空间站获得甲烷(CH4)的微观示意图。请回答下列问题:

-
(1) 反应前后,不变的微粒是。
-
(2) 该反应的化学方程式为。
-
(3) 该化学反应的微观实质是。
现有一包由铁粉、木炭粉、镁粉组成的固体混合物5g,向其中加入一定溶质质量分数的稀盐酸100g,充分反应后过滤,得到滤液103.8g、滤渣1g,下列说法中正确的是( )
A . 生成氢气的质量是0.2g
B . 滤液中一定含有氯化镁、氯化亚铁和盐酸
C . 稀盐酸的溶质质量分数小于或等于7.3%
D . 若滤渣的成分是木炭粉,则混合物中铁、镁的质量比为7:3
烧杯A中盛有一定量的碳酸钠溶液,进行如图所示的实验。

-
(1) 碳酸钠溶液显碱性,得出此结论的依据是。
-
(2) 步骤②中发生反应的化学方程式为。
-
(3) 步骤③观察到的现象是。
在 100mL 烧杯中加入 20g0.4%的氢氧化钠溶液,滴加 2~3 滴酚酞试液,再逐滴滴加 0.365%的稀盐酸, 关于反应过程中的说法正确的是( )
A . 溶液由无色变为红色
B . 溶液可能不变色
C . 产生大量热,烧杯变烫,形成大量水雾
D . 当溶液为无色时,溶质的质量分数为 0.3%
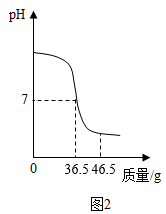
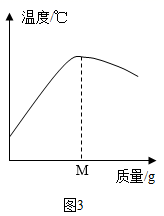
中和反应是一类重要的化学反应,某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,分别取稀盐酸和氢氧化钠溶液各50g进行实验,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。已知所选稀盐酸的溶质质量分数为10%。

-
(1) 仪器A中溶液的溶质是(填化学式),图1烧杯中溶液的溶质各元素的质量比。
-
(2) 图3中M的数值最接近g。
-
(3) 求所用氢氧化钠溶液的溶质质量分数(写出计算过程)。
利用催化剂将废气中的二氧化碳转化为燃料 X,是实现“碳中和”的路径之一。该反应的化学方程式为 CO2+3H2 催化剂 X+H2O,X 的化学式为( )
A . CO
B . CH4
C . CH3OH
D . C2H5OH
分类、类比是初中化学常用的学习方法。
-
(1) 设计化学实验时除了考虑能否达到实验目的外,还要考虑“实验安全、对环境的影响、节约药品”等因素。据此,我们可以将实验A与实验(填字母)归为一类,分类依据是。




A.在通风橱中进行
B.将试管换成白瓷板
C.集气瓶底部铺水
D.装置右侧加一个酒精灯
-
(2) 已知氨水(NH3·H2O)是一种可溶性碱,在水中能解离出
 和OH-。请写出氨水与硫酸发生中和反应的化学方程式,氨水中氮元素的化合价是。
和OH-。请写出氨水与硫酸发生中和反应的化学方程式,氨水中氮元素的化合价是。
化学与人类的生活有密切的联系。
-
(1) 生活中干净、卫生的自来水属于(填“纯净物”或“混合物”)。
-
(2) 南昌瓦罐汤不仅营养,而且闻着鲜美,让人食欲大开,从分子的角度解释“闻着鲜美”的原因:。
-
(3) 含磷洗衣粉中含有Na5PxO10 , 其洗涤废水的任意排放会污染环境,已知在上述化合物中磷的化合价为+5,则x应为。
-
(4) “84消毒液”中的次氯酸钠的制取原理是氯气(Cl2)与氢氧化钠反应生成氯化钠、次氯酸钠(NaClO)和水,该反应的符号表达式为。
回答下列问题。
-
(1) (一)从石灰石中获取高纯度碳酸钙的工业流程如下:

煅烧炉中化学反应的基本反应类型为。
-
(2) 反应①为反应(选填“吸热”或“放热”)。
-
(3) 操作I的名称为。
-
(4) (二)A、B、C、D、E、F为初中化学常见物质,它们的转化关系如下图所示,其中A和C的组成元素相同,D和E的组成元素相同,且A、C、D、E均为氧化物,B、F为单质,B能使带火星的木条复燃,D能使澄清石灰水变浑浊。

请写出下列物质的化学式:AF;
-
(5) 请写出C→B的反应方程式;请写出F→E的反应方程式。
下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A . 4p+5O2  2P2O5(产生白雾)
B . 2NaOH+CuCl2=Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C . AgNO3+HCl=AgCl↓+HNO3(产生白色沉淀)
D . H2O2
2P2O5(产生白雾)
B . 2NaOH+CuCl2=Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C . AgNO3+HCl=AgCl↓+HNO3(产生白色沉淀)
D . H2O2  H2O+O2↑(冒气泡)
H2O+O2↑(冒气泡)
 2P2O5(产生白雾)
B . 2NaOH+CuCl2=Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C . AgNO3+HCl=AgCl↓+HNO3(产生白色沉淀)
D . H2O2
2P2O5(产生白雾)
B . 2NaOH+CuCl2=Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C . AgNO3+HCl=AgCl↓+HNO3(产生白色沉淀)
D . H2O2  H2O+O2↑(冒气泡)
H2O+O2↑(冒气泡)
如图所示,下列图像反应的对应关系错误的是( )
A . 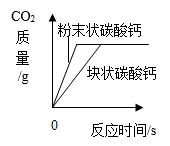 质量相同的粉末状碳酸钙和块状碳酸钙与足量的稀盐酸反应
B .
质量相同的粉末状碳酸钙和块状碳酸钙与足量的稀盐酸反应
B . 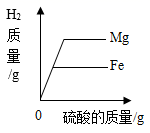 分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C .
分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C . 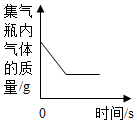 碳在盛有氧气的密闭集气瓶内燃烧
D .
碳在盛有氧气的密闭集气瓶内燃烧
D . 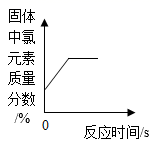 加热一定质量氯酸钾和二氧化锰的固体混合物
加热一定质量氯酸钾和二氧化锰的固体混合物
 质量相同的粉末状碳酸钙和块状碳酸钙与足量的稀盐酸反应
B .
质量相同的粉末状碳酸钙和块状碳酸钙与足量的稀盐酸反应
B .  分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C .
分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C .  碳在盛有氧气的密闭集气瓶内燃烧
D .
碳在盛有氧气的密闭集气瓶内燃烧
D .  加热一定质量氯酸钾和二氧化锰的固体混合物
加热一定质量氯酸钾和二氧化锰的固体混合物
根据下列反应事实写出相应的化学方程式。
-
(1) 过氧化氢溶液在二氧化锰的催化作用下生成水和氧气:。
-
(2) Cu与AgNO3溶液反应,生成Cu(NO3)2溶液和Ag。
鸡蛋壳的主要成分是碳酸钙,为了测定某鸡蛋壳中碳酸钙的含量,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g放在烧杯里,然后往烧杯中加入足量的稀盐酸90g,充分反应后,称得烧杯中物质的总质量为97.8g.(假设鸡蛋壳中的其他物质不与盐酸反应)
-
(1) 产生二氧化碳气体g。
-
(2) 恰好完全反应后生成氯化钙的质量
-
(3) 计算10g该鸡蛋壳中碳酸钙的质量。
如图是某化学反应的微观过程,下列说法正确的是( )

A . 该反应中涉及三种氧化物
B . 生成物中丙和丁的分子个数比2:3
C . 化学反应前后分子的数目不变
D . 反应前后有两种元素化合价发生改变
为测定某赤铁矿样品中氧化铁的含量,化学兴趣小组同学将赤铁矿样品粉碎,取赤铁矿样品25g于烧杯中,加入200g溶质质量分数为13.7%的稀盐酸,恰好完全反应。(样品中杂质不溶于水,也不与盐酸发生反应)
-
(1) 稀盐酸溶液溶质的质量为g。
-
(2) 赤铁矿样品中氧化铁的质量。(计算结果保留整数)
乙烯是一种重要的化工原料,下图是制备乙烯的某反应微观示意图,关于该反应的说法错误的是( )

A . 参加反应的甲、乙分子个数比为1:3
B . 乙中氢元素化合价为+1价
C . 丙的化学式为C2H4
D . 丁中氢、氧元素的质量比为1:8
某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。用该废渣制取CaCl2晶体(CaCl2·H2O)并进行组成测定,其制取的流程如图所示:

已知:NH4Cl溶液显酸性,且浓度越高酸性越强。
-
(1) XRD图谱可用于判断某固态物质是否存在。如题图为锻烧前后废渣的XRD图谱。写出锻烧时发生的化学方程式:。
-
(2) 浸取时需连续搅拌,其目的是。写出产生氨气的化学方程式。

-
(3) 在其他条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。则宜选择的浸取温度为℃左右。

-
(4) 若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、(填化学式)等杂质。
-
(5) 测定晶体(CaCl2·xH2O)的组成,步骤如下:
a.称取14.70 g CaCl2晶体于锥形瓶内,加入适量蒸馏水,使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
c.过滤、洗涤、干燥、称量,得到10.00g固体。
①通过计算,确定x的值:。
②判断步骤b中沉淀完全的方法是:静置,,则说明已沉淀完全。
下图描述的是某反应在同一容器中反应前后部分分子种类的微观示意图,该反应中A与B的微粒数目之比为( )

A . 1:1
B . 4:5
C . 5:4
D . 2:3
如图是工业上用菱锰矿(主要成分为MnCO3 , 含FeCO3等杂质)为原料来制取二氧化锰的简易工艺流程,请根据题意回答问题。

-
(1) 写出盐酸与MnCO3反应的化学方程式。
-
(2) ②处操作的名称是,该操作中用到的玻璃仪器有烧杯、玻璃棒和。
-
(3) 溶液1中加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为:
 , 则物质X的化学式为。
, 则物质X的化学式为。
-
(4) 加入K2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,其原因是。
涂覆在铺路石表面的TiO2可净化路面空气。实验室制备TiO2的流程如下:

-
(1) 焙炒时,钛铁矿的主要成分FeTiO3在蒸发皿(如图)中发生反应,
 。实验中用沙浴加热,图中还缺少的玻璃仪器是。
。实验中用沙浴加热,图中还缺少的玻璃仪器是。
-
(2) 焙炒物冷却后,加水溶解浸取。
①浸取时,水温易升高的原因是。
②浸取后,混合物经(填操作名称)弃去废渣,得到浸出液。
-
(3) 浸出液除铁后,所得滤液中含TiOSO4和H2SO4。加热煮沸滤液,TiOSO4和水反应生成H2TiO3沉淀和H2SO4 , 该反应的化学方程式为。
-
(4) 煅烧H2TiO3沉淀得产品TiO2。整个实验流程中可循环利用的物质除水外,还有。
最近更新



