第五单元 化学方程式 知识点题库

-
(1) 原固体中氯化钡的质量是多少?
-
(2) 滴加的硫酸钠溶液溶质质量分数为多少?
-
(1) 木炭在氧气中充分燃烧;
-
(2) 镁在氧气中燃烧;
-
(3) 铁丝在氧气中燃烧。
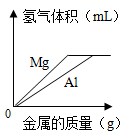 金属镁和铝分别放入等量、等浓度的稀盐酸中
B .
金属镁和铝分别放入等量、等浓度的稀盐酸中
B . 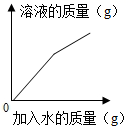 无水硫酸铜中逐滴滴加水
C .
无水硫酸铜中逐滴滴加水
C . 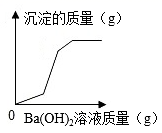 盐酸酸化的MgSO4溶液中滴加Ba(OH)2溶液
D .
盐酸酸化的MgSO4溶液中滴加Ba(OH)2溶液
D . 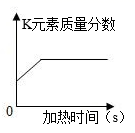 加热氯酸钾和二氧化锰的混合物
加热氯酸钾和二氧化锰的混合物

(已知: 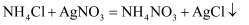 ;杂质不含氮元素且不与硝酸银溶液反应)。
;杂质不含氮元素且不与硝酸银溶液反应)。
-
(1) 反应生成氯化银的质量为g。
-
(2) 通过计算,判断该化肥是否合格?(写出计算过程,结果精确到0.1%)
-
(3) 恰好完全反应后,将所得溶液蒸干,得到的晶体可作为氮肥使用,其含氮量(填“<”、“>”或“=”)原样品中含氮量。
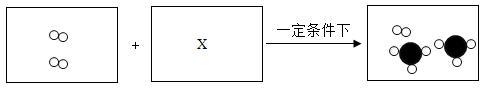
 B .
B .  C .
C . 
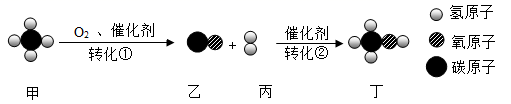
-
(1) 高铁刹车片由合金锻钢制作,时速300公里以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700℃以上。合金锻钢应该具备耐磨和等特性。
-
(2) 某种服装的面料是涤纶,里料是棉,区分这两种纤维最简单的方法是。
-
(3) 次氯酸(HClO)具有杀菌消毒作用。制取HClO反应为
 ,则X的化学式为。
,则X的化学式为。
-
(4) SO2是引起酸雨的主要物质,实验室可将SO2通入NaOH溶液中转化成Na2SO3而除去,发生反应的化学方程式为。
-
(1) 石灰石中碳酸钙的质量为g。
-
(2) 反应后所得溶液的溶质质量分数(结果精确到0.1%)。
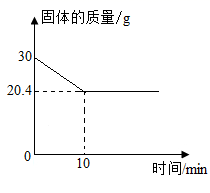
-
(1) 生成氧气的质量是g。
-
(2) 该样品中氯酸钾的质量。

(提出问题)化学反应中,参加反应的物质质量总和与生成物的质量总和是否相等?
(进行实验)
实验一:1756年,俄国科学家罗蒙诺索夫,把锡放在密闭容器里锻烧,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。
实验二:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
实验三:同学们利用红磷燃烧进行实验,装置如图所示,结果反应前后质量相等。
(实验分析)
-
(1) 实验一中若放入锡的质量为m克,密闭容器内氧气的质量为n克,则生成的氧化锡的质量可能______克;A . 等于m+n B . 大于m+n C . 小于m+n
-
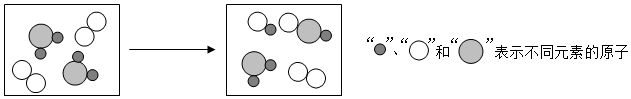
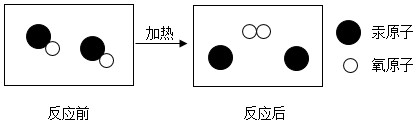
(2) 实验二中发生反应的微观图示如图,该反应中没有发生变化的微粒名称是;
-
(3) 实验三中点燃红磷后气球的变化情况为;若锥形瓶底部不铺细沙,会导致;
-
(4) (交流讨论)
下列关于上述三个实验的共同点描述中,正确的是______;
A . 三个实验中涉及的反应均属于分解反应 B . 三个实验变化前后原子的种类、数目、质量都不变 C . 三个实验中所用的药品均需稍过量,否则影响实验结果 -
(5) (拓展迁移)
已知氢气在氯气中燃烧,可用化学方程式表示为
 ,则X的化学式为;
,则X的化学式为; -
(6) 如图是某反应中固体物质质量变化情况,下列与之相符的化学反应是______;
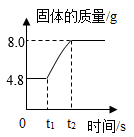 A .
A . B .
B .  C .
C . 
-
(1) 探究一:包装袋内的气体成分是什么?
(猜想与假设)包装袋内的气体为:
猜想1:氧气;猜想2:氮气;猜想3:二氧化碳;猜想4:二氧化硫;猜想5:空气。
通过分析,大家认为猜想1是错误的,理由是氧气的化学性质比较(填“活泼”或“不活泼”),易与食品发生缓慢氧化而变质;猜想4也是错误的,理由是。
-
(2) (查阅资料)
①镁能与氧气在点燃条件下反应,生成物常温下不溶于水也不与水反应;
②镁也能与二氧化碳在点燃条件下反应,生成一种黑色单质和一种金属氧化物;
③镁还能在氮气中燃烧,反应生成氮化镁(Mg3N2)固体;
④氮化镁在常温下能与水反应生成能使无色酚酞溶液变红的物质。
(进行实验)
实验一:抽取包装袋内气体一瓶,向其中加入一定量的澄清石灰水,振荡,观察不到石灰水变浑浊的现象,小明据此推断只有猜想2成立。小红不同意此结论,理由是。
实验二:另抽取包装袋内气体一瓶,将燃着的木条伸入瓶中。观察到木条立即熄灭,小组同学据此判断猜想不成立,猜想2成立。
为进一步确认猜想2成立,小组同学进行了实验三:
实验操作
实验现象
结论
①另取一瓶包装袋内的气体,向其中伸入燃着的镁条,观察现象;
镁条燃烧,发出耀眼的白光
猜想2成立
②取少量反应后的固体,加入足量的蒸馏水中,并滴入酚酞溶液,观察现象。
-
(3) (实验反思)写出上述实验操作①中化学方程式。
-
(4) (拓展延伸)
①明明同学将镁条打磨成光亮的银白色后,利用如图进行测定空气中氧气含量实验。将镁条点燃后迅速伸入盛有空气的集气瓶中,反应完全,冷却至室温后打开止水夹,发现进入集气瓶中的水体积约为其容积的70%,可能原因是。
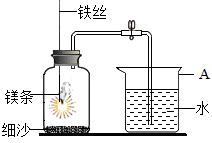
②1.2g镁条在某氧气和氮气的混合气体中完全燃烧,所得固体质量可能是(填序号)。
A.1.8g B.2.0g C.2.2g D.2.4g
-
(1) 木炭在足量的氧气中燃烧:;
-
(2) 细铁丝在氧气中燃烧:;
-
(3) 加热氧化汞:。
除夕的夜晩,烟花在空中绽放,绚丽无比。烟花又称花炮、烟火、焰火,主要用于典礼或表演中。
烟花和爆竹的组成类似,其中都包含黑火药。黑火药由硝酸钾、木炭和硫粉混合而成,一定条件下引燃会发生剧烈反应,瞬间产生大量由二氧化碳、氮气等组成的混合气体,同时释放大量热。由于气体体积急剧膨胀,压力猛烈增大,于是发生爆炸。在军事上,黑火药是弹药的重要组成部分,可用作枪弹、炮弹的发射药等。
制作烟花的过程中,还加入一些发光剂和发色剂,它们使烟花呈现五彩缤纷的颜色。发光剂是金属镁或金属铝的粉末。发色剂是一些金属化合物,不同金属元素的化合物在火焰上灼烧时,发出不同颜色的光芒。例如,氯化钠和硫酸钠等物质在火焰上灼烧时会发出黄色光芒;含铜化合物会发出绿色光芒。因此,人们常通过燃放烟花来烘托节日气氛,但黑火药燃烧会产生有害气体,也带来一些环境问题。
-
(1) 黑火药是一种(选填“混合物”或“纯净物”)。
-
(2) 黑火药爆炸时,除二氧化碳、氮气以外的其他产物中一定含(填元素符号)元素。
-
(3) 镁粉在空气中燃烧的主要反应的化学方程式为。
-
(4) 为减少燃放烟花爆竹造成的大气污染,可采取的措施有(答一点即可)。
石墨相氮化碳/碳量子点的纳米复合物是一种新型的复合光催化剂,它可以利用太阳光实现高效分解水,其原理如图1所示。
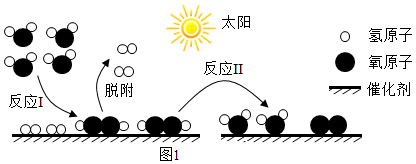
-
(1) 该反应原理实现了能向化学能的转化,反应Ⅱ是(填放热或吸热)反应。
-
(2) 反应中的纳米复合物经烘干后可以直接反复使用,其原因是。
-
(3) 该反应原理的总反应化学方程式为。
-
(4) 氮化碳中碳元素和氮元素的质量之比为9:14,碳元素的化合价为+4,氮元素的化合价为。
-
(5) 反应Ⅱ的原理可用于实验室制取氧气,以图2所示装置进行如下实验。(室温为20℃,氧气浓度传感器初始读数为A,水浴时间均为5分钟)
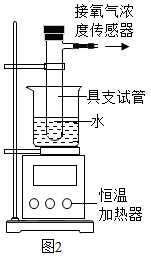
实验编号
具支试管内的试剂
水浴温度
试管内现象
传感器读数
I
10mL蒸馏水1mL2%H2SO4溶液
20℃
无气泡
A
40℃
极少量气泡
A
Ⅱ
10mL30%H2O2溶液1mL2%H2SO4溶液
20℃
无气泡
A
40℃
少量气泡
B
Ⅲ
10mL30%H2O2溶液1mL2%CuSO4溶液
20℃
少量气泡
C
40℃
大量气泡
D
①实验I试管中产生的气泡是溶解在水中的空气,说明气体的溶解性受影响。
②实验I的目的是。
③实验中氧气浓度传感器的读数大小为:A
分析对比实验Ⅰ、实验Ⅱ,由A(填“能”或“不能”)得出H2SO4能加快H2O2溶液的分解速率的结论。
分析对比实验Ⅱ、实验Ⅲ,可以得出以下结论:由C可知。
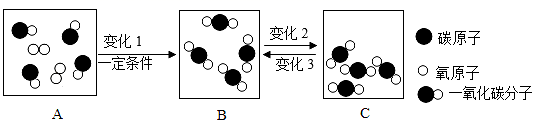
-
(1) A,B,C中表示混合物的是。
-
(2) 上述变化1,2和3中,属于化学变化的是,请写出其文字表达式:,该变化前后不变的粒子是(填粒子名称)。变化3中,微粒(填“吸收”或“释放”)能量。
-
(3) (查阅资料)①常温常压下,二氧化碳是一种没有颜色、没有气味的气体②无毒③密度比空气大④熔点—78.45℃⑤沸点—56.55℃⑥二氧化碳能参与植物的光合作用⑦二氧化碳与水生成碳酸⑧二氧化碳可用于灭火、作制冷剂等。二氧化碳的物理性质有(写序号,下同)。二氧化碳的化学变化有;二氧化碳的化学性质有。如图为金星大气中某物质的分子结构示意图。它与二氧化碳的性质不同是因为。
①用作消毒剂的75%的医用酒精,就是指每100体积的医用酒精中含75体积的乙醇
②中和反应一定生成盐和水,所以生成盐和水的反应一定是中和反应
③食品添加剂是用于改善食品品质、延长食品保存期、增加食品营养成分的一类化学合成或天然的物质
④1.6g的某气体充分燃烧,生成2.2g二氧化碳和1.8g水,则该气体只含碳、氢元素,一定不含氧元素
⑤在密闭容器中放入甲、乙,丙、丁四种物质,一定条件下发生化学反应,一段时间后,测得相关数据如图所示。该反应中丁物质一定是化合物

⑥某固体可能由氯化钠、硫酸钠,氯化钡、氯化镁、硫酸钾中的一种或几种组成,取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解,则该固体的组成有4种情况

-
(1) K₂CO3和Na2CO3具有相似的化学性质,其水溶液显碱性。则取一定量草木灰,加水浸泡,将上层浸出液过滤。再用试管取少量滤液,加入几滴无色酚酞试液,溶液变色。
-
(2) 下列有关草木灰的说法错误的是 (填选项序号之一)A . 草木灰与铵态氮肥混合使用效果更好 B . 草木灰在农村农业生产中,主要作为钾肥使用 C . 草木灰可促使植株生长健壮,增强其抗病虫和抗倒伏的能力 D . 科学、合理地使用草木灰,才能发挥其肥效
-
(3) 现有K2CO3和NaCl的固体混合物5g,将其放入干净烧杯中,加入一定量的水充分溶解,向溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸。烧杯中溶液的质量与加入稀盐酸的质量关系如图所示。
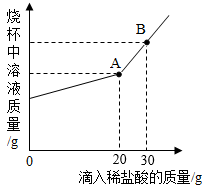
①反应过程中出现的现象:。
②当滴加稀盐酸至30g即B点时,烧杯中溶液里的阴离子是(写化学符号)。
③试根据图示有关数据计算固体混合物中碳酸钾的质量。
-
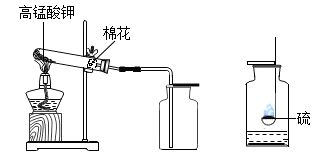
(1) 试管口棉花的作用是。
-
(2) 检验氧气集满的方法是。
-
(3) 制取氧气的主要步骤如下,正确的顺序是(填序号)。
①装入药品,开始加热 ②停止加热 ③收集气体 ④组装仪器,检查气密性
-
(4) 硫在氧气中燃烧的现象是。
-
(5) 根据化学方程式计算,制取0.96g氧气,至少需要高锰酸钾的质量是?