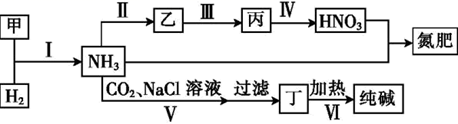
课题2 人工固氮技术——合成氨 知识点题库
(1)实验室制取氨气的化学方程式是 .
(2)工业上氨气可以由氢气和氮气合成如图1.

①该反应的热化学方程式是 .
②随着温度的升高,该反应的化学平衡常数的变化趋势是 .
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 (填字母).
④简述一种检查氨气是否泄露可采用的化学方法: .
(3)工业制硫酸的尾气中含较多的SO2 , 为防止污染空气,回收利用SO2 , 工业上常用氨水吸收法处理尾气.
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8L SO2时,溶液中的溶质为 .
②(NH4)2SO3显碱性,用化学平衡原理解释 .
③NH4HSO3显酸性.用氨水吸收SO2 , 当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母).
a.c(NH4+)=2c(SO32﹣)+c(HSO3﹣)
b.c(NH4+)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(NH4+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理如图2:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液.
②空气在进入电池装置前需要通过过滤器除去的气体是 .
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 .
 NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
步骤1:按图连接好实验装置,……………………….。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
-
(1) 将步骤1补充完整:
-
(2) 干燥管中盛放的药品是
-
(3) 对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有(写出一种即可)。
-
(4) 三颈烧瓶中产生氨气的原理是。
-
(5) 反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是。
-
(6) 尾气处理装置中双通玻璃管的作用是(用文字叙述),浓硫酸的作用是、。
-
(7) 取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为。
 2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。 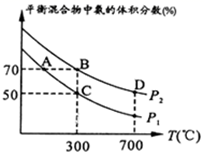
①恒压时,反应一定达到平衡状态的标志是(填序号)
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.  保持不变 D.
保持不变 D. 
②该反应的平衡常数表达式K=,∆H。
③比较大小:P1P2 , 理由是
④平衡时B、D两点的正反应速率:υ(B)υ(D)。(填“<”或“>”或“=”)
-
(1) 在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)
 2NH3(g)。该可逆反应达到平衡的标志是。
2NH3(g)。该可逆反应达到平衡的标志是。 a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
-
(2) 工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min
CH4(mol)
H2O(mol)
CO(mol)
H2(mol)
0
0.40
1.00
0
0
5
a
0.80
c
0.60
7
0.20
b
0.20
d
10
0.21
0.81
0.19
0.64
①写出工业用天然气原料制取氢气的化学方程式:。
②分析表中数据,判断5min时反应是否处于平衡状态?(填“是”或“否”),前5min反应的平均反应速率v(CH4)=。
③反应在7~10min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2

-
(1) 如图所示氮循环中,属于氮的固定的有(填字母序号)。
a.
 转化为铵态氮 b.硝化过程 c.反硝化过程
转化为铵态氮 b.硝化过程 c.反硝化过程 -
(2) 氮肥是水体中铵态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为。
②检验铵态氮肥中
 的实验方案是。
的实验方案是。 -
(3) 铵态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为mol。
-
(4) 常温下氨气能被氯气氧化生成
 ,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。
,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。 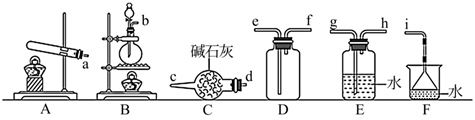
Ⅰ.氨气的制备。欲制备和收集一瓶干燥的氨气可以选择图中的装置(填大写字母)。
Ⅱ.氯气与氨气的反应(已知:实验前
 、
、  关闭)。
关闭)。
①打开
 ,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭
,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭  ,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。
,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。②再打开
 ,可观察到的现象是。
,可观察到的现象是。
-
(1) 氮在元素周期表的位置为,其非金属性比磷(填“强”或“弱”)。氮气的化学性质很稳定,原因是。
-
(2) 1909年,德国科学家哈伯利用氮气和氢气在500~600℃、18.5~20.0
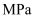 和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生
和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生 -
(3) 某兴趣小组在实验室中探究氮的氧化物的性质。
①利用铜和稀硝酸制取NO,化学方程式为,该反应中还原剂与氧化剂物质的量之比为。
②探究氮的氧化物性质的实验步骤及预期现象如下表:

步骤
预期现象
i.在一支注射器中吸入22.4mLNO(标准状况下),然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器
无明显现象
ii.打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,固定住注射署活塞
iii.松开注射器活塞,再振荡注射器
重复操作ii和iii,充分反应后,注射器中的溶液浓度为mol/L(假设反应前后液的体积几乎不变)。
-
(4) 利用
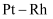 合金催化氧化
合金催化氧化 制取
制取 , 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
, 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
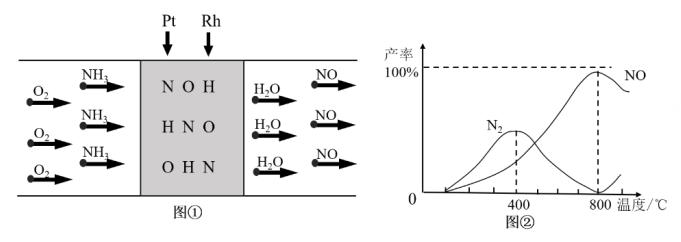 A . 可用湿润的蓝色石蕊试纸检验
A . 可用湿润的蓝色石蕊试纸检验 是否反应完全
B . 400℃时,生成的产物只有
是否反应完全
B . 400℃时,生成的产物只有 、
、 C . 800℃以上,可能发生反应:
C . 800℃以上,可能发生反应: D .
D . 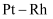 合金催化氧化
合金催化氧化 制取
制取 , 适宜的温度为800℃
, 适宜的温度为800℃
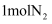 和
和 充入某密闭容器中,控制适当条件使其充分反应生成
充入某密闭容器中,控制适当条件使其充分反应生成 。下列关于合成氨反应的说法正确的是( )
。下列关于合成氨反应的说法正确的是( )
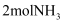
 制碳酸氢铵和尿素
B .
制碳酸氢铵和尿素
B .  和
和 在一定条件下合成
在一定条件下合成 C . 雷电时,空气中的
C . 雷电时,空气中的 与
与 反应生成
反应生成 D . 豆科植物把空气中的氮气转化为化合态的氮
D . 豆科植物把空气中的氮气转化为化合态的氮



