课题2 金属材料 知识点题库
下列叙述正确的是 ( )
A . 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
B . 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
C . 废电池需回收,主要是要利用电池外壳的金属材料
D . 升高温度可降低活化能
下列关于金属腐蚀的叙述正确的是( )
A . 本质是:M+nH2O=M(OH)n+ 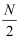 H2↑
B . 电化学腐蚀必须在酸性条件下进行
C . 化学腐蚀比电化学腐蚀更普遍
D . 本质是:M﹣ne﹣=Mn+
H2↑
B . 电化学腐蚀必须在酸性条件下进行
C . 化学腐蚀比电化学腐蚀更普遍
D . 本质是:M﹣ne﹣=Mn+
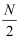 H2↑
B . 电化学腐蚀必须在酸性条件下进行
C . 化学腐蚀比电化学腐蚀更普遍
D . 本质是:M﹣ne﹣=Mn+
H2↑
B . 电化学腐蚀必须在酸性条件下进行
C . 化学腐蚀比电化学腐蚀更普遍
D . 本质是:M﹣ne﹣=Mn+
下列冶炼金属的原理中,属于热还原法的是( )
A . 2Ag2O  4Ag+O2↑
B . Fe2O3+3CO
4Ag+O2↑
B . Fe2O3+3CO  2Fe+3CO2↑
C . Fe+CuSO4=FeSO4+Cu
D . MgCl2
2Fe+3CO2↑
C . Fe+CuSO4=FeSO4+Cu
D . MgCl2  Mg+Cl2↑
Mg+Cl2↑
 4Ag+O2↑
B . Fe2O3+3CO
4Ag+O2↑
B . Fe2O3+3CO  2Fe+3CO2↑
C . Fe+CuSO4=FeSO4+Cu
D . MgCl2
2Fe+3CO2↑
C . Fe+CuSO4=FeSO4+Cu
D . MgCl2  Mg+Cl2↑
Mg+Cl2↑
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A . SO2常用于纸张等植物纤维的漂白
B . 工业上可用铝热反应大规模炼铁
C . 光导纤维的主要成允是SiO2
D . 电解熔融MgCl2 , 可制得金属镁
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

-
(1) 数天后铁钉明显锈蚀的装置是;
-
(2) 铁制品锈蚀的条件是;
-
(3) 铁钉生锈主要属于腐蚀(填“化学”或“电化学”).
铁及其化合物在国民经济的发展中起着重要作用.
-
(1) 铁在潮湿的空气中易发生电化学腐蚀.某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图1所示.液滴边缘是﹣﹣区(填“正极”或“负极”),其电极反应式为.

-
(2) 铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有;
①2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
③.
-
(3) 高铁酸钠(Na2FeO4)是一种优良的水处理剂.
①FeO42﹣在水溶液中的存在形态如图2所示,纵坐标表示各存在形态的分数分布.下列说法不正确的是(填字母序号).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4﹣的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4﹣+OH﹣═FeO42﹣+H2O
②从环境保护的角度看,制备高铁酸盐的较好方法为电解法.用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式
.铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是.
若维持电流强度为5.0A,电解20min,理论上可生成Na2FeO4g.(已知:F=96500C/mol,答案保留两位有效数字)
下列有关原电池的说法中,正确的是( )
A . 铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B . 铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C . 镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D . 将反应2Fe3++Fe═3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
能有效防止铁质栏杆锈蚀的措施是( )
A . 接上铜网
B . 定期擦去铁锈
C . 与石墨相连
D . 定期涂上油漆
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )

A . 金属的导电性强弱
B . 金属在地壳中的含量多少
C . 金属的化合价高低
D . 金属的活动性强弱
下列说法正确的是( )
A . 石油的分馏、煤的干馏都是化学变化
B . PCl3分子中各原子属于8电子结构
C . 海水含溴元素,向海水中加入苯可以提取单质溴
D . 用电解氯化钠饱和溶液制取钠
下列说法错误的是()
A . 钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+
B . 钢铁发生吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-
C . 破损后的镀锌铁板比镀锡铁板更耐腐蚀
D . 用牺牲阳极的阴极保护法保护钢铁,钢铁作原电池的负极
化学与社会、生活、生产密切相关,下列有关说法中正确的是( )
A . 漂白粉溶液可用于夏天游泳池杀菌消毒
B . 菜刀洗净后擦干是为了防止发生化学腐蚀
C . 区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
D . 安装煤燃烧过程的固硫“装置,主要是为了提高煤的利用率
下列过程需要通电才能进行的是( )
①电离②电解③电镀④电化学腐蚀
A . ①②
B . ②④
C . ②③
D . 全部
在下列过程中,需要加快化学反应速率的是( )
A . 炼钢
B . 食物腐败
C . 钢铁腐蚀
D . 塑料老化
改革开放40周年取得了很多标志性成果,下列说法错误的是( )
A . “中国天眼”的镜片材料为SiC,属于新型无机非金属材料
B . “蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C . 北斗导航专用ASIC硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为SiO2
D . 港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极保护法
下列说法正确的是( )
A . 常温下2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O可自发进行,则该反应的ΔH﹤0
B . 用牺牲阳极的阴极保护法来保护钢闸门时,可用锌板作为牺牲阳极
C . 常温下,向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中  ·c(OH-)值不变
D . Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023
·c(OH-)值不变
D . Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023
 ·c(OH-)值不变
D . Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023
·c(OH-)值不变
D . Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023
镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:
-
(1) 已知还原性Mg > Si,上述反应仍能发生的原因是。
-
(2) 由图推测上述反应正向为(填“吸热”或“放热”)反应。

-
(3) 若还原炉体积不变,能证明上述反应达到平衡的是(选填序号)。
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
-
(4) 平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将(填“升高”“降低”或“不变”)。
-
(5) 若还原炉容积为400 m3 , 原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率 mol/(L·h)。
-
(6) 工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
MgCl2
MgO
熔点/℃
712
2850
①镁原子核外有种能量不同的电子,它们的运动状态有种。
②MgCl2的电子式为;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
下列说法错误的是( )
A . 燃煤发电和潮汐发电均是将化学能转化为电能
B . 电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
C . 铁表面镀锌时,铁作阴极
D . 使用植物秸秆转化而来的乙醇为燃料,不会额外增加大气中  的含量
的含量
 的含量
的含量
图I的目的是精炼铜,图II的目的是保护钢闸门。下列说法正确的是( )
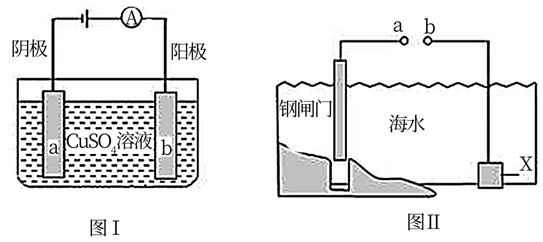

A . 图I中a为纯铜
B . 图I中 向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
 向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象

已知: 和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
A . 发生氧化反应的是a处和d处
B . 图A中a处出现蓝色沉淀
C . b处和c处电极反应式为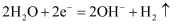 D . 对铁钉腐蚀起防护作用的是图B
D . 对铁钉腐蚀起防护作用的是图B
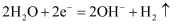 D . 对铁钉腐蚀起防护作用的是图B
D . 对铁钉腐蚀起防护作用的是图B
最近更新



