第三节 盐类的水解 知识点题库
室温下,有pH均为9体积均为10mL的NaOH溶液和CH3COONa溶液,下列说法正确的是( )
A . 两种溶液中的c(Na+)相等
B . 两溶液中由水电离出的c(OH﹣)之比为  C . 分别加水稀释到100mL时,两种溶液的pH依然相等
D . 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
C . 分别加水稀释到100mL时,两种溶液的pH依然相等
D . 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
 C . 分别加水稀释到100mL时,两种溶液的pH依然相等
D . 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
C . 分别加水稀释到100mL时,两种溶液的pH依然相等
D . 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
已知某酸H2B在水溶液中存在下列关系:①H2B⇌H++HB﹣ , ②HB﹣⇌H++B2﹣ . 关于该酸对应的酸式盐NaHB的溶液,
下列说法中一定正确的是( )
A . NaHB属于弱电解质
B . 溶液中的离子浓度c(Na+)>c(HB﹣)>c(H+)>c(OH﹣)
C . c(Na+)=c(HB﹣)+c(B2﹣)+c(H2B)
D . NaHB和NaOH溶液反应的离子方程式为H++OH﹣=H2O
室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )

A . Ⅱ表示的是滴定醋酸的曲线
B . pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C . V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D . V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
室温下,0.1mol•L﹣1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是( )
A . c(Na+)>c(OH﹣)>c(HCO3﹣)>c(CO32﹣)>c(H+)
B . c(H+)+c(Na+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
C . 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3﹣)+c(CO32﹣)
D . Ka1(H2CO3)•Ka2(H2CO3)<Kw
现将标准状况下的2.24L HCl气体溶解在含有0.2mol醋酸钠溶液的烧杯中,测得溶液体积为1L.若此溶液中c(CH3COO﹣)>c(Cl﹣),则下列判断中不正确的是( )
A . c(CH3COO﹣)+c(OH﹣)=0.10 mol•L﹣1
B . c(CH3COOH)+c(CH3COO﹣)=0.20 mol•L﹣1
C . c(CH3COOH)<c(CH3COO﹣)
D . 温度为298 K时,pH<7
已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确的是( )
m(NaOH)/g | 0 | 0.4 | 0.8 | 1.2 |
pH | 3.8 | 8.3 | 12.0 | 13.2 |
A . H2A第一步电离K1的数量级为10-8
B . 上述过程中水的电离程度一直增大
C . m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D . 若溶液中加NaOH至  时,c(OH-)>100c(H+)
时,c(OH-)>100c(H+)
 时,c(OH-)>100c(H+)
时,c(OH-)>100c(H+)
下列物质溶于水后因水解显酸性的是( )
A . NH4NO3
B . NaHSO4
C . KCl
D . KHCO3
常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa , 下列有关叙述错误的是()

A . 常温下,Ka(CH3COOH)=10-5
B . a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C . 常温下,0.1mo/LNaF溶液的pH小于0.1mo/LCH3COONa溶液的pH
D . 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 

聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法错误的是( )
A . KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3
B . 生成聚合硫酸铁后,水溶液的pH增大
C . 聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D . 在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
下列说法正确的是 ( )
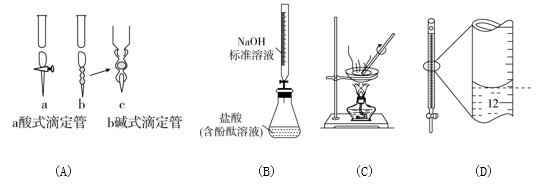
A . 碱式滴定管注入Na2CO3溶液之前应检查是否漏液
B . 测定盐酸浓度
C . 蒸干AlCl3饱和溶液制备AlCl3晶体
D . 记录滴定终点读数为12.20 ml
下列说法关于离子浓度说法错误的是( )
A . 室温下,向0.20 mol/L NH4HCO3中通入CO2至溶液呈中性:c(NH4+)=c(HCO3-)+2c(CO32-)
B . 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH4+)>c ( OHˉ)>c (H+)
C . 向0.30mol/L Na2SO3中通入CO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D . 10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c (Cl﹣)>c(OH-)>c(H+)
在一隔热系统中,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH 溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )

A . 若a点溶液呈酸性,此时:c(CH3COO-) -c(CH3COOH) =2c (H+)-2c(OH-)
B . 从a到b:  逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
 逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
下列有关说法正确的是( )
A . 在Na2S溶液中加入少量的Na2S固体,Na2S的水解程度减小
B . Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)室温下不能自发进行,说明该反应的ΔH>0
C . 用碱式滴定管量取20.00mL酸性高锰酸钾溶液
D . 室温下,pH分别为2和4的盐酸等体积混合后,溶液pH=3
下列图示或根据图示所得出的结论正确的是( )
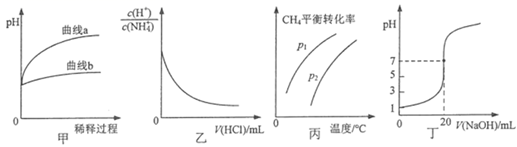
A . 图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B . 图乙表示温度不变,向0.1mol·L-1NH4Cl溶液中滴加0.1mol·L-1盐酸时,溶液中 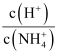 随盐酸体积的变化关系
C . 图丙表示密闭容器中CH4(g)+ H2O(g)⇌CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D . 图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
随盐酸体积的变化关系
C . 图丙表示密闭容器中CH4(g)+ H2O(g)⇌CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D . 图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
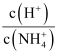 随盐酸体积的变化关系
C . 图丙表示密闭容器中CH4(g)+ H2O(g)⇌CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D . 图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
随盐酸体积的变化关系
C . 图丙表示密闭容器中CH4(g)+ H2O(g)⇌CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D . 图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
25℃时,用NaOH调节H3AsO4溶液的pH,溶液中含砷物种的分布系数δ与pH的关系如图所示.[H3AsO4的分布系数:δ(H3AsO4)=  ]
]
 ]
] 
下列说法错误的是( )
A . 升高温度,H3AsO4溶液的pH减小
B . H3AsO4的第一步电离常数的数量级为10-3
C . M点溶液中存在c(Na+)=2c(HAsO 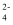 )+3c(AsO
)+3c(AsO 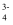 )
D . pH=11时溶液中离子浓度:c(HAsO
)
D . pH=11时溶液中离子浓度:c(HAsO 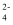 )>c(AsO
)>c(AsO 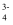 )>c(H2AsO
)>c(H2AsO  )
)
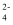 )+3c(AsO
)+3c(AsO 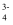 )
D . pH=11时溶液中离子浓度:c(HAsO
)
D . pH=11时溶液中离子浓度:c(HAsO 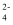 )>c(AsO
)>c(AsO 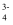 )>c(H2AsO
)>c(H2AsO  )
)
下列实验操作、现象及结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将Fe(NO3)2样品溶于足量的H2SO4溶液中,再滴加少量的KSCN溶液 | 溶液不变红 | 溶液中一定没有Fe3+ |
| B | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子浓度均减小 |
| C | 向Na2CO3稀溶液中逐滴滴入同浓度、同体积的水杨酸( | 无气体产生 | 电离常数:K1(碳酸)>K2(水杨酸) |
| D | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液 | 无淡黄色沉淀 | CH3CH2Br没有水解 |
A . A
B . B
C . C
D . D
根据各图曲线表征的信息,得出的结论错误的是( )

A . 图1表示常温下向体积为10 ml.0.1 mol/L的NaOH 溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则c点处有:c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-)
B . 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a
C . 图3中在b点对应温度下,将pH=2的H2SO4 , 与pH=10的NaOH溶液等体积混合后,溶液显中性
D . 由图4曲线,可确定K(AgCl)>K(AgBr)>K(AgI),故用0.0100 mol/L.硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl- , Br-及I-的混合溶液时,首先沉淀的是I-
25℃时,对于浓度均为0.1 mol/L的三种溶液:①醋酸、②氢氧化钠、③醋酸钠溶液,下列说法错误的是( )
A . c(CH3COO-):③>①
B . 水电离出的c(H+):③>①>②
C . 25℃时,①和②等体积混合后的溶液:  D . 25℃时,①和③等体积混合后的溶液:
D . 25℃时,①和③等体积混合后的溶液: 
 D . 25℃时,①和③等体积混合后的溶液:
D . 25℃时,①和③等体积混合后的溶液: 
硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域等。某化学实验小组图-1装置制备  。
。
 。
。

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图-2所示。
-
(1) 若要检验a处混合气体中的CO2 , 实验方法是:将混合气体。
-
(2) 三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的。
-
(3) 设计以下实验测定以上制备
 的纯度:
的纯度:
步骤1.准确称取8.00g样品,溶于水,.加入5mL甲醛,配成100mL溶液。
步骤2.准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸德水溶解,再加入5mL
 H2SO4和20mL10%KI溶液使铭元素完全转化为Cr3+ , 加水稀释至100mL。
H2SO4和20mL10%KI溶液使铭元素完全转化为Cr3+ , 加水稀释至100mL。步骤3.向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:
 )
)①写出“步骤2”中反应的离子方程式。
②试计算
 的纯度(写出计算过程)
的纯度(写出计算过程) -
(4) 利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备
 晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,,洗涤、干燥得
晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,,洗涤、干燥得  晶体。(实验中须使用的试剂及仪器有:氧气、pH计)
晶体。(实验中须使用的试剂及仪器有:氧气、pH计)
用0.1000 的NaOH溶液滴定20.00mL浓度分别为c1、c2的醋酸、草酸(
的NaOH溶液滴定20.00mL浓度分别为c1、c2的醋酸、草酸( )溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点:
)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点:
 的NaOH溶液滴定20.00mL浓度分别为c1、c2的醋酸、草酸(
的NaOH溶液滴定20.00mL浓度分别为c1、c2的醋酸、草酸( )溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点:
)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点:
下列叙述错误的是( )
A . X曲线代表草酸,Y曲线代表醋酸, B . 若b点时
B . 若b点时 , 则b点消耗了8.60mL的NaOH溶液
C . 对于
, 则b点消耗了8.60mL的NaOH溶液
C . 对于 而言,滴定过程中始终有
而言,滴定过程中始终有 D . 若a点
D . 若a点 , 则a点有
, 则a点有
 B . 若b点时
B . 若b点时 , 则b点消耗了8.60mL的NaOH溶液
C . 对于
, 则b点消耗了8.60mL的NaOH溶液
C . 对于 而言,滴定过程中始终有
而言,滴定过程中始终有 D . 若a点
D . 若a点 , 则a点有
, 则a点有
最近更新



