第三节 盐类的水解 知识点题库
(1)“热解气还原法”:CO还原SO2生成S4和CO2 , 反应的化学方程式为
(2)“湿式吸收法”:利用吸收剂与SO2发生反应从而脱硫
①下列试剂中适合用作该法吸收剂的是 (填字母,下同).
a.澄清石灰水 b.浓硫酸 c.Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100mL,0.2mol•L﹣1NaOH溶液通入标准状况下0.448LSO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是
a.c(HSO3﹣)>c(SO42﹣)>c(H2SO3)
b.c(OH﹣)+c(SO32﹣)=c(H+)+c(H2SO3)
c.c(Na+)+c(H+)=c(HSO3﹣)+c(SO32﹣)+c(OH﹣)
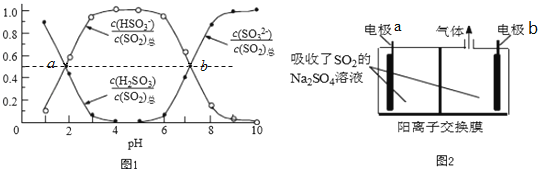
③工业上常用Na2SO4溶液吸收烟气中的SO2 , 将烟气通入1.0mol•L﹣1的Na2SO4溶液,溶液pH不断减小(设这个过程中溶液体积不变),当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32﹣)=0.2mol•L﹣1 , 则溶液中c(HSO3﹣)=
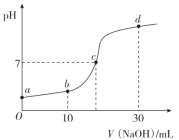
④“亚硫酸铵吸收法”用(NH4)2SO3溶液在吸收塔中封闭循环脱轨,发生的主要反应为(NH4)2SO3+SO2+H2O=2NH4HSO3 , 测得25℃时溶液pH与各组分物质的量分数的变化关系如图1所示.a点时n(HSO3﹣):n(H2SO3)= ,b点时溶液pH=7,则n(NH4+):n(HSO3﹣)=
(3)“离子膜电解法”利用硫酸钠溶液吸收SO2 , 再用惰性电极电解,将阴极X溶液导出,经过滤分离硫磺后,可循环吸收利用,装置如图2所示,则阴极的电极反应式为 ,阳极产生的气体的化学式为 .
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)⇌2ClNO(g)+Q2 K2 (Ⅱ)
-
(1) 4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用含K1、K2的代数式表示).
-
(2) 为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3mol•L﹣1•min﹣1 , 则平衡后n(Cl2)= mol,NO的转化率а1= .其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是
-
(3) 实验室可用NaOH溶液吸收NO2 , 反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为 .(已知HNO2的电离常数Ka=7.1×10﹣4mol•L﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1 , 可使溶液A和溶液B的pH相等的方法是 .
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.溶液B中加适量NaOH.
名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
沸点(℃) | 64.7 | 7.4 | 153℃ | ﹣24.9 | 90℃ |
-
(1) 在425℃、Al2O3作催化剂,甲醇与氨气反应可以制得二甲胺,二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为;
-
(2) 甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO⇌(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为反应(填“吸热”、“放热”).
-
(3) 甲醇制甲醚的化学方程式为:2CH3OH⇌CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CH3OH
CH3OCH3
H2O
Ⅰ
387
0.20
x
Ⅱ
387
0.40
y
Ⅲ
207
0.20
0.090
0.090
①x/y=;
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正 v逆(填“>”、“<”或“=”)
-
(4) 以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.

写出阳极的电极反应式.
 ) >c(SO
) >c(SO  )>c(H2SO3)
D . 0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液中:c(CO
)>c(H2SO3)
D . 0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液中:c(CO  ) >c(HCO3-) >c(OH-) >c(H2CO3)
) >c(HCO3-) >c(OH-) >c(H2CO3)

 将增大
D . 浓度均为0.1 mol/L的下列溶液①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4中c(NH4+)的大小关系为①>②>④>③
将增大
D . 浓度均为0.1 mol/L的下列溶液①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4中c(NH4+)的大小关系为①>②>④>③
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3溶液 ⑤Ca(HCO3)2溶液 ⑥KHSO4溶液
 )分别为a、b、c(单位为mol·L-1),下列判断正确的是( )
)分别为a、b、c(单位为mol·L-1),下列判断正确的是( )
 。向含0.01 mol
。向含0.01 mol 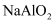 和0.02 mol NaOH的稀溶液中缓慢通入CO2 , 溶液中,
和0.02 mol NaOH的稀溶液中缓慢通入CO2 , 溶液中,  随通入的
随通入的  的变化如图,下列对应关系正确的是( )
的变化如图,下列对应关系正确的是( ) 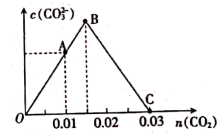
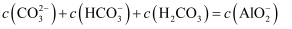 B . B点:
B . B点: 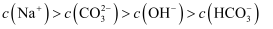 C . C点:
C . C点:  D . O点:
D . O点: 
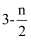 )]m。
)]m。
-
(1) Na2S2O8为氧化剂处理DSS制备Fe2(SO4)3 , 反应过程如下:
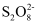
 (硫酸根自由基)
(硫酸根自由基) 
 +Fe3+ , 反应②的离子方程式是。
+Fe3+ , 反应②的离子方程式是。
-
(2) Fe2(SO4)3经水解、聚合两步连续反应制得聚合硫酸铁。
①水解反应:(离子方程式)。
②聚合反应:mFe2(OH)n(SO4)(
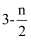 )=[Fe2(OH)n(SO4)(
)=[Fe2(OH)n(SO4)( 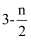 )]m
)]m -
(3) 测定并改进聚合硫酸铁絮凝剂的性能
①表征聚合硫酸铁絮凝剂性能的重要指标是盐基度(OH-与Fe3+的物质的量比值),盐基度越大絮凝效果越好。测定某聚合硫酸铁样品盐基度的方案如下,请补全步骤并计算。
资料:KF溶液可以掩蔽Fe3+使其不与OH-反应。
取ag样品,完全溶解于V1mLc1mol/L盐酸中,,滴入酚酞溶液,用c2mol/LNaOH溶液滴定至终点,消耗NaOH溶液体积为V2mL;另取ag样品,测得Fe3+的物质的量为bmol。该样品的盐基度为(列出表达式)。
②某小组利用如图电解装置来提高聚合硫酸铁的盐基度。A是聚合硫酸铁溶液,B是提高盐基度后的聚合硫酸铁溶液。
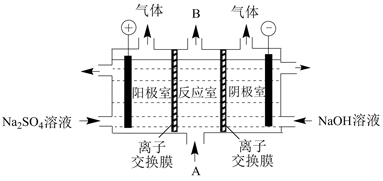
i.离子交换膜是(填“阴”或“阳”)离子交换膜。
ii.简述反应室中提高盐基度的原理:。
 与水反应时,增加水的用量可以明显加快化学反应速率
C . 纯碱溶液清洗油污时,加热可以增强其去污力
D . 向海水中加入净水剂明矾可以使海水淡化
与水反应时,增加水的用量可以明显加快化学反应速率
C . 纯碱溶液清洗油污时,加热可以增强其去污力
D . 向海水中加入净水剂明矾可以使海水淡化
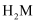 溶液中,
溶液中,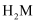 、
、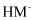 、
、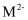 的浓度对数lgc随pH的变化如图。下列说法错误的是( )
的浓度对数lgc随pH的变化如图。下列说法错误的是( )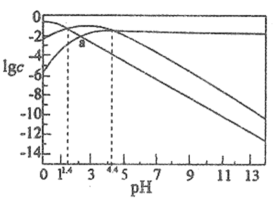
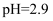 B . 适当升高温度,a点会右移
C . 随pH增加,
B . 适当升高温度,a点会右移
C . 随pH增加,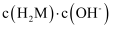 先增大后减小
D .
先增大后减小
D .  溶液中:
溶液中: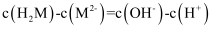
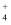 )=c(Ba2+)
B . 向氨水中通入CO2 , 随着CO2的增加,
)=c(Ba2+)
B . 向氨水中通入CO2 , 随着CO2的增加, 增大
C . 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-)
D . 25℃时,某稀溶液中由水电离产生的c(H+)和c(OH-)的乘积为
增大
C . 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-)
D . 25℃时,某稀溶液中由水电离产生的c(H+)和c(OH-)的乘积为 该溶液的pH不可能是7
该溶液的pH不可能是7



