第二节 化学电源 知识点题库
镉镍可充电池在现代生活中有着广泛的应用,它的充、放电反应如下:Cd+2NiOOH+2H2O  Cd(OH)2+2Ni(OH)2请回答下列问题:
Cd(OH)2+2Ni(OH)2请回答下列问题:
 Cd(OH)2+2Ni(OH)2请回答下列问题:
Cd(OH)2+2Ni(OH)2请回答下列问题:
-
(1) 上述反应式中左边物质的总能量(填“大于”“小于”或“等于”)右边物质的总能量.
-
(2) 放电时负极发生反应的物质是,放电是正极的反应式为.
关于铅蓄电池的说法正确的是( )
A . 在放电时,正极发生的反应是 Pb(s)+SO42﹣(aq)=PbSO4(s)+2e﹣
B . 在放电时,该电池的负极材料是铅板
C . 在充电时,电池中硫酸的浓度不断变小
D . 在充电时,阳极发生的反应是 PbSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
-
(1) 铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置是第①周期、第②族;PbO2的酸性比CO2的酸性③(填“强”或“弱”).
-
(2) PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为④.
-
(3) PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为⑤;PbO2也可以通过石墨为电极,Pb(NO3)2与Cu(NO3)2的混合溶液为电解液电解制取,阳极发生的电极反应式为⑥,阴极上观察到得现象是⑦;若电解液中不加入Cu(NO3)2 , 阴极发生的电极反应式为⑧,这样做的主要缺点是⑨.
-
(4) PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即
 ×100%)的残留固体.若a点固体组成表示为PbOx或mPbO2•nPbO,列式计算x值和m:n值⑩.
×100%)的残留固体.若a点固体组成表示为PbOx或mPbO2•nPbO,列式计算x值和m:n值⑩. 
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH﹣4e﹣+H2O═CH3COOH+4H+ . 下列有关说法正确的是( )
A . 检测时,电解质溶液中的H+向负极移动
B . 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C . 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O
D . 正极上发生的反应为:O2+4e﹣+2H2O═4OH﹣
某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+ , 其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )

A . 电子通过外电路从b极流向a极
B . b极上的电极反应式为:O2+2H2O+4e﹣═4OH﹣
C . 每转移0.1mol电子,消耗1.12L的H2
D . H+由a极通过固体酸电解质传递到b极
电子表和电子计算器的电源通常用微型银﹣锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )
A . Zn是正极,Ag2O是负极
B . Zn是负极,Ag2O是正极
C . 工作时负极区溶液的pH增大
D . 工作时电子由Ag2O极经外电路流向Zn极
写出锌锰干电池的电极反应方程式,碱性锌锰干电池的总反应:
2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2
负极: 正极:.
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O  Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法不正确的是( )
 Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法不正确的是( )
A . 电池的电解质溶液为碱性溶液,阳离子向正极移动
B . 电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2
C . 电池充电过程中,阴极附近溶液的pH降低
D . 电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣═Ni2O3+3H2O
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成分判断正确的是( )

A . a为正极,b为负极;NaClO和NaCl
B . a为负极,b为正极;NaClO和NaCl
C . a为阳极,b为阴极;HClO和NaCl
D . a为阴极,b为阳极;HClO和NaCl
下列有关电池的说法错误的是( )
A . 手机上用的锂离子电池属于二次电池
B . 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C . 甲醇燃料电池可直接把化学能转化为电能
D . 铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A . 正极反应中有CO2生成
B . 微生物促进了反应中电子的转移
C . 质子通过交换膜从负极区移向正极区
D . 电池总反应为C6H12O6+6O2=6CO2+6H2O
钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO4·2H2O)的流程如下:
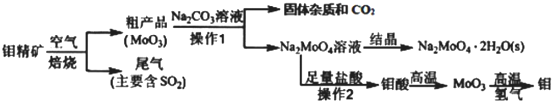
-
(1) Na2MoO4·2H2O中Mo元素的化合价为;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为。
-
(2) 流程中由Na2MoO4溶液获得晶体的操作是、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为。
-
(3) 操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8 , 溶液体积变化可忽略]
-
(4) 工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是。
-
(5) 高纯Mo可用于制造电池级MoS2 , Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2
 Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
我国成功研制的一种新型可充放电AGDIB电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是( )

A . B为负极,放电时铝失电子
B . 电解液可以用常规锂盐和水代替
C . 放电时A电极反应式为CxPF6+e-=Cx+PF6-
D . 放电时,若转移1mol电子,石墨电极上可增重7g
将两根Pt电极插入KOH溶液中,再向两极上分别通入甲烷和氧气就可构成
燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O;关于此燃料电池的下列说法中,正确的是( )
A . 在燃料电池工作时,在装置内部可以看见淡蓝色火焰
B . 通入氧气的电极为负极
C . 通入甲烷的电极的电极反应式为:CH4 + 10OH- - 8e-= CO32- + 7H2O
D . 电池工作一段时间后,溶液的pH基本不变
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,总反应为2Na+xS  Na2Sx , 其反应原理如图所示。下列叙述正确的是( )
Na2Sx , 其反应原理如图所示。下列叙述正确的是( )
 Na2Sx , 其反应原理如图所示。下列叙述正确的是( )
Na2Sx , 其反应原理如图所示。下列叙述正确的是( ) 
A . 放电时,电极a为正极
B . 放电时,内电路中Na+的移动方向为从b到a
C . 充电时,电极b的反应式为Sx2--2e-=xS
D . 充电时,Na+在电极b上获得电子,发生还原反应
科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法错误的是( )

A . 过程I得到的Li3N中N元素为—3价
B . 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C . 过程Ⅲ中能量的转化形式为化学能转化为电能
D . 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
电能是现代社会应用最广泛的能源之一。

-
(1) 某原电池装置如图所示。其中,Zn电极为原电池的极(填“正”或“负”),电极反应式是。Cu电极上发生的反应属于(填“氧化”或“还原”)反应。电子由极流出(Zn或Cu),电解质溶液中SO
 移向(Zn或Cu)。
移向(Zn或Cu)。
-
(2) 下列反应通过原电池装置,可实现化学能直接转化为电能的是(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
炒过菜的铁锅未及时洗净(残液中含  ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
 ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( ) 
A . 腐蚀过程中,负极是  ,发生电极反应:
,发生电极反应:  B .
B .  失去电子经电解质溶液转移给C
C . 正极的电极反应式为
失去电子经电解质溶液转移给C
C . 正极的电极反应式为  D . C是正极,
D . C是正极,  在C表面上发生还原反应
在C表面上发生还原反应
 ,发生电极反应:
,发生电极反应:  B .
B .  失去电子经电解质溶液转移给C
C . 正极的电极反应式为
失去电子经电解质溶液转移给C
C . 正极的电极反应式为  D . C是正极,
D . C是正极,  在C表面上发生还原反应
在C表面上发生还原反应
按要求回答问题:
-
(1) 以
 和
和  为电极,稀
为电极,稀 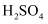 为电解质溶液形成的原电池中:
为电解质溶液形成的原电池中: ①
 向极移动(填“正”或“负”)。
向极移动(填“正”或“负”)。②若有
 流过导线,则理论上负极质量减少g。
流过导线,则理论上负极质量减少g。③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
-
(2) 氢气是未来最理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水时,实现了从太阳能转变为化学能。生成的氢气用于燃料电池时,实现化学能转变为电能。分解海水的反应属于(填“放热”或“吸热”)反应。
-
(3) 有人以化学反应:
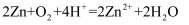 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的
为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的  进行工作。则原电池的负极材料是锌,发生的电极反应为。
进行工作。则原电池的负极材料是锌,发生的电极反应为。
-
(4) 常温下,暴露在空气中的生铁容易发生吸氧腐蚀,请写出正极的电极反应式。
氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如图1.通过控制开关连接K1或K2 , 可交替得到H2和O2。

-
(1) ①制H2时,连接, 产生H2的电极反应式是;
②改变开关连接方式,可得O2.结合①和②中电极3的电极反应式,说明电极3的作用:。
-
(2) 用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一、Fe还原水体中
)已成为环境修复研究的热点之一、Fe还原水体中  的反应原理如图2所示。作负极的物质是,正极的电极反应式是。
的反应原理如图2所示。作负极的物质是,正极的电极反应式是。
最近更新



