课题二 物质的制备 知识点题库
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如图:
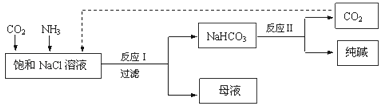
有关说法错误的是( )
一学习小组用100g某硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4•7H2O),主要流程如图:
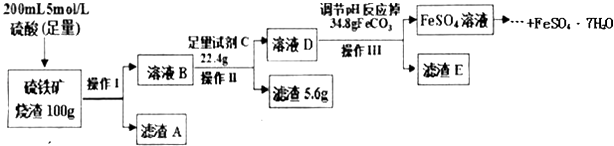
请回答下列问题:
-
(1) 硫铁矿烧渣中加入硫酸酸浸往往需要升温,目的是,操作1的名称是,滤渣A是.
-
(2) 试剂C为,加入该试剂的目的是(用离子方程式表示).
-
(3) 调节溶液D的pH目的是.
-
(4) 已知常温下Al(OH)3的Ksp=1.0×10﹣33 , 若溶液中c(Al3+)为1.0mol/L,请计算Al3+开始沉淀的pH=.
-
(5) 依据上述流程中的相关数据,求该硫铁矿烧渣中Fe2O3的质量分数为.(本实验各操作中损失的硫酸盐、硫酸及调pH后溶液呈微酸性残留的硫酸忽略不计)
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒、酒精灯 | 1.0mol/L FeCl3溶液、蒸馏水 |
C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.100 0mol/L盐酸、酚酞溶液 |
选项 | 实验操作及现象 | 结论 |
A | 常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大 | 酸性:CH3COOH>HClO |
B | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生 | 淀粉没有水解 |
C | 向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于稀硫酸前已氧化变质 |
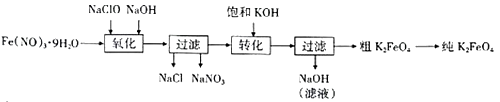
已知高铁酸钾的部分性质如下:
① 热稳定性差,溶液的pH对其稳定性的影响也很大;即在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定。
② 在水中溶解度大,难溶于无水乙醇等有机溶剂。
③ 具有强氧化性,能氧化烃、80%以下的乙醇溶液等物质。
回答下列问题:
-
(1) 该生产工艺应在温度(填“较高”或“较低”)的情况下进行。
-
(2) 上述氧化过程中,发生反应的离了方程式为。
-
(3) 由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾
① 加入饱和KOH溶液的目的是:。
② 由以上信息可知:Ksp(K2FeO4)Ksp(Na2FeO4)(填“大于”或“小于”)。
-
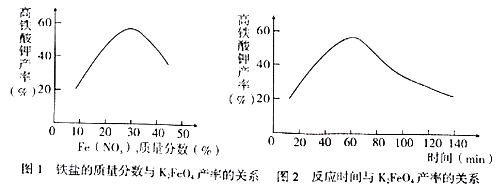
(4) 实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图l、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在附近、反应时间应控制在。
-
(5) 粗K2FeO4→纯K2FeO4包括重结晶、过滤、洗涤、干燥几个步骤。洗涤、干燥的目的是脱碱、脱水,洗涤时最好用洗涤。
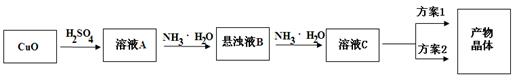
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+  Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
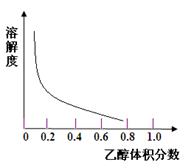
请根据以上信息回答下列问题:
-
(1) 方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是。
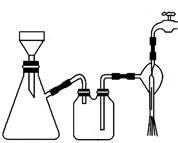
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有杂质,产生该杂质的原因是。
-
(2) 方案2的实验步骤为:a.向溶液C中加入适量,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:。
③步骤d采用干燥的方法。
①在30mL的大试管A中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min。
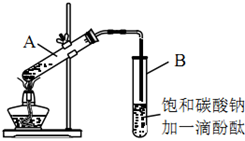
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
已知下列数据:
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | ―― | 338.0 | 1.84 |
请回答下列问题:
-
(1) 配制该混合溶液时,加入这三种物质的先后顺序是;写出制取乙酸乙酯的化学方程式:。
-
(2) 该实验中,浓硫酸的作用是。
-
(3) 上述实验中饱和碳酸钠溶液的作用是___________(填字母)。A . 吸收部分乙醇 B . 中和乙酸 C . 降低乙酸乙酯的溶解度,有利于分层析出 D . 加速酯的生成,提高其产率
-
(4) 步骤②中需要小火均匀加热操作,其主要理由是。
-
(5) 步骤③中B试管内的上层物质是(填物质名称)。
-
(6) 步骤④中分离操作用到的主要仪器是;可选用的干燥剂为(填字母)。
A. 生石灰 B. NaOH固体
C. 碱石灰 D. 无水Na2SO4
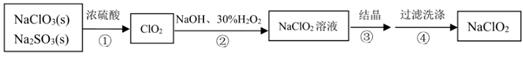
已知:ClO2浓度过高时易发生分解, NaClO2高于60℃时易分解, NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出 NaClO2。
下列说法不正确的是( )
-
(1) 操作①的名称是。
-
(2) 向滤液中加入双氧水的作用是。
-
(3) 试剂a可以是(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
-
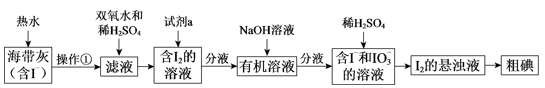
(4) I–和IO3-在酸性条件下生成I2的离子方程式是。
-
(5) 上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是。
| 选项 | 实验 | 现象 | 结论 |
| A | 向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl固体 | 溶液颜色变浅 | FeCl3+3KSCN |
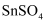 常用于印染和电镀工业.某研究小组设计
常用于印染和电镀工业.某研究小组设计 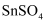 的制备路线如图:
的制备路线如图: 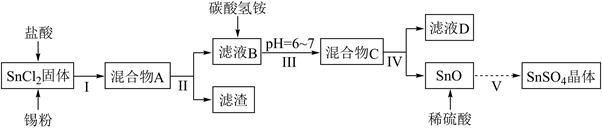 已知:
已知: 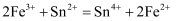 ;强酸性条件下,锡元素在水溶液中有
;强酸性条件下,锡元素在水溶液中有  、
、  两种主要存在形式,
两种主要存在形式, 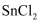 极易水解,生成对应的碱式盐。
极易水解,生成对应的碱式盐。
-
(1) 锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是。
-
(2)
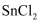 用盐酸溶解而不用水直接溶解的原因是;加入
用盐酸溶解而不用水直接溶解的原因是;加入 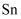 粉的作用有两个;①调节溶液
粉的作用有两个;①调节溶液  ②。
②。
-
(3) 步骤Ⅱ中用到的玻璃仪器有;
-
(4) 酸性条件下,
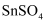 还可以用作双氧水去除剂,发生反应的离子方程式是。
还可以用作双氧水去除剂,发生反应的离子方程式是。
-
(5) 向
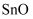 中加入稀硫酸的作用之一是控制溶液的
中加入稀硫酸的作用之一是控制溶液的  .若溶液中
.若溶液中 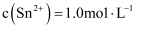 ,则室温下应控制溶液
,则室温下应控制溶液  取值范围为(已知
取值范围为(已知  )
)
-
(6) 该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取
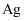 锡粉溶于盐酸中,向生成的
锡粉溶于盐酸中,向生成的  中加入过量的
中加入过量的  溶液,用
溶液,用  滴定生成的
滴定生成的  (已知酸性环境下,
(已知酸性环境下,  可被还原为
可被还原为  不能被
不能被  氧化),共用去
氧化),共用去  溶液
溶液 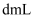 .则锡粉中锡的质量分数为.(
.则锡粉中锡的质量分数为.( 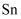 的摩尔质量为
的摩尔质量为 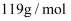 ,用含a、b、d的最简代数式表示)
,用含a、b、d的最简代数式表示)
 固体
B . 用
固体
B . 用 气体和NaOH溶液做喷泉实验
C . 直接加热
气体和NaOH溶液做喷泉实验
C . 直接加热 固体制备氨气
D . 用Mg、Al、NaOH溶液设计一个原电池装置,且Mg做电池的负极
固体制备氨气
D . 用Mg、Al、NaOH溶液设计一个原电池装置,且Mg做电池的负极
| 装置 | 实验 | 试剂a | 现象与结果 |
| | I | 10h后,液体变为浅蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 | |
| II | 8mL5mol/L氨水 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 | |
| III | 8mL5mol/L氨水和1gNH4Cl固体 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜片依然保持光亮 |
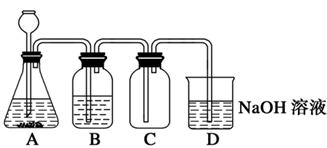
下列说法错误的是( )
| 序号 | 操作 | 现象 | 解释或结论 |
| A | 在含0.1 mol的AgNO3溶液中依次加入NaCl溶液和KI溶液 | 溶液中先有白色沉淀生成,后来又变成黄色 | Ksp(AgCl)>Ksp(AgI) |
| B | 取FeSO4少许溶于水,加入几滴KSCN溶液 | 溶液变红色 | FeSO4全部被氧化 |
| C | 将纯净的乙烯气体通入酸性KMnO4溶液 | 溶液紫色褪去 | 乙烯具有还原性 |
| D | 在Ca(ClO)2溶液中通入SO2气体 | 有沉淀生成 | 酸性: H2SO3> HClO |
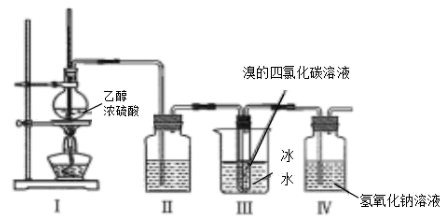
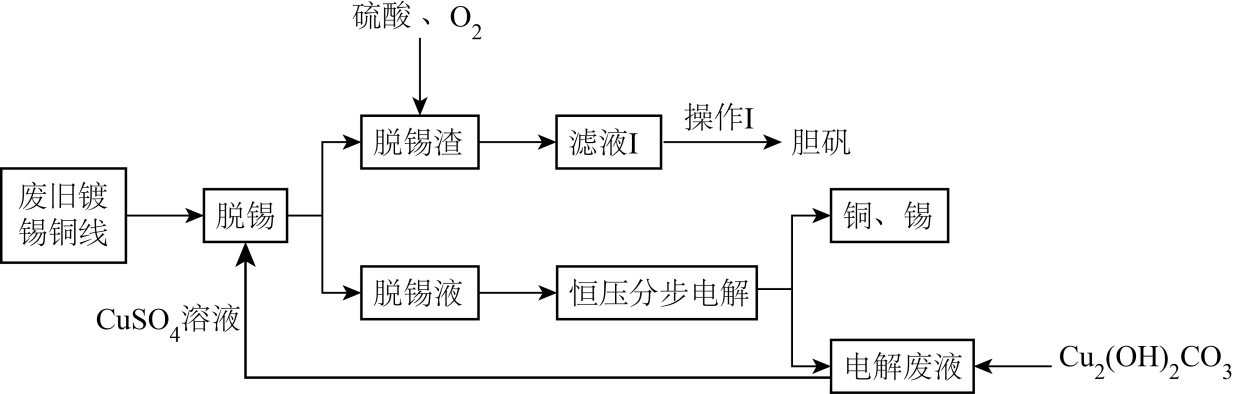
已知Sn2+容易水解。
回答下列问题:
-
(1) 加快“脱锡”速率的措施有(写出一点)。“操作I” 包含、、过滤、洗涤、干燥。
-
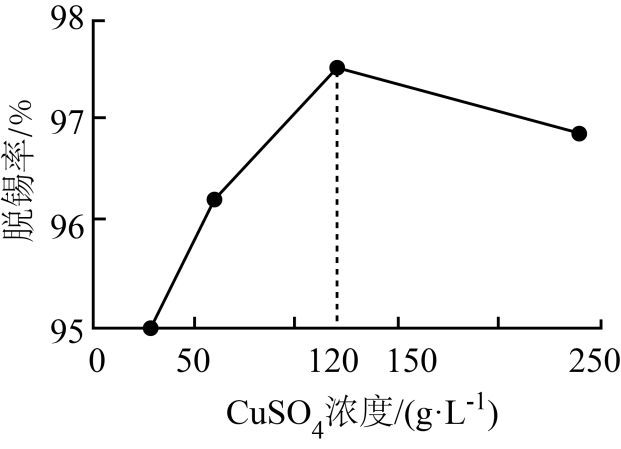
(2) “脱锡”过程中加入少量稀硫酸调控溶液pH,其目的是;硫酸铜浓度与脱锡率的关系如图所示,当浓度大于120g·L-1时,脱锡率下降的原因。
-
(3) “脱锡液”中含有的离子主要为Cu2+、Sn2+、H+、SO
 , 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。
, 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。
-
(4) “脱锡渣”溶于硫酸的离子方程式为。
-
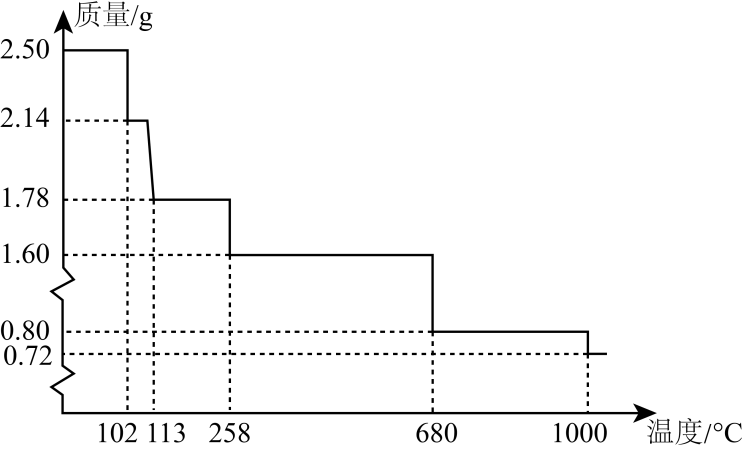
(5) 称量纯净的胆矾2.50g进行热重分析,实验测得胆矾的热重曲线如图所示。则120℃时所得固体的化学式为。
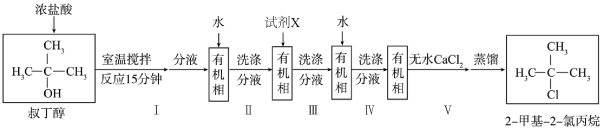
下列说法错误的是( )




