第二单元 研究物质的实验方法 知识点题库
药品柜编号 | ① | ② | ③ | ④ | … |
药品 | 氢氧化钠 氢氧化钙 | 盐酸 硫酸 | 二氧化锰 氧化铜 | 氯化钠 硫酸钠 | … |

 Sr等释放β射线的放射性物质浓度上升,创开始检测以来的最高值.为了警示人们应贴的警示标志是( )
Sr等释放β射线的放射性物质浓度上升,创开始检测以来的最高值.为了警示人们应贴的警示标志是( )
 B .
B .  C .
C .  D .
D . 
① Al ② Na2O ③ Na2O2 ④ NaOH ⑤ NaCl

-
(1) 气体1的成分除H2O(g)外,还有,步骤①中发生氧化还原反应的化学方程式为 ,滤液1的主要成分的用途之一为。
-
(2) 目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有(答出两点)。
-
(3) 步骤④调pH所用试剂为 。
-
(4) 室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38 , 则滤液3中c(Fe3+)=。
-
(5) 步骤⑤操作为.。
-
(6) 假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为。

| 选项 | 目的 | 操作 |
| A | 测定稀CH3COOH溶液物质的量浓度 | 选甲基橙做指示剂,标准NaOH溶液滴定 |
| B | 鉴别CO2和SO2气体 | 将气体分别通入硝酸钡溶液中 |
| C | 比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,比较pH大小 |
| D | 比较Fe3+和Cu2+对H2O2分解的催化效果 | 向两支装有2mL5%H2O2溶液的试管中分别滴加2滴0.1mol·L-1的FeCl3和CuSO4溶液 |
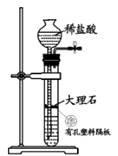 B . 除杂、干燥
B . 除杂、干燥  C . CO2与锌粉反应
C . CO2与锌粉反应 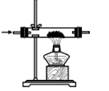 D . 检查 CO
D . 检查 CO 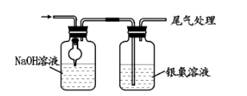

下列说法正确的是( )
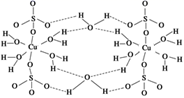
 与水分子之间存在氢键
与水分子之间存在氢键

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
-
(1) ①实验中控制氯气与空气的体积比的方法是。
②使用多孔球泡的作用是。
-
(2) ①装置B中产生Cl2O的化学方程式为。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是。
-
(3) 装置C中采用棕色圆底烧瓶是因为。
-
(4) 已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用量取20.00 mL次氯酸溶液于烧杯中,。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
实验目的 | 方案设计 | 现象和结论 | |
A | 检验火柴头上氯元素的存在 | 摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加入稀 | 若产生白色沉淀,说明火柴头上含有氯元素 |
B | 检验 | 取少量固体于试管中,加足量的硫酸铜溶液充分反应,过滤,取滤渣用稀硫酸溶解,将溶液分成两份:一份滴加几滴 | 若前者溶液变血红色,后者溶液紫色褪去,则固体中铁元素有 |
C | 检验淀粉水解程度 | 淀粉溶液中加入稀硫酸,加热,冷却后再加入碘水 | 向若溶液不变蓝,说明淀粉已完全水解 |
D | 探究 |
| 未加 |
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 过量的 Fe 粉中加入稀硝酸,充分反应后,滴加 KSCN 溶液 | 溶液呈红色 | 稀硝酸将 Fe 氧化为 Fe3+ |
| B | 向装有 Fe(NO3)2溶液试管中加入稀H2SO4 | 试管口观察到红棕色气体 | HNO3被还原成了 NO2 |
| C | 向某溶液中加入足量稀盐酸无现象,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 原溶液中存在 |
| D | 向盛有某溶液的试管中滴加稀 NaOH 溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
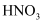 酸化的
酸化的 溶液,充分振荡
溶液,充分振荡 粉中是否含有
粉中是否含有
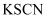 溶液,另一份滴加少量
溶液,另一份滴加少量 溶液
溶液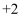 、
、 两种价态,说明固体中含有
两种价态,说明固体中含有 与
与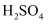 的反应
的反应 固体
固体



