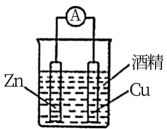
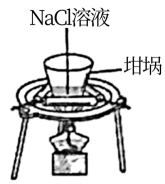
第二单元 研究物质的实验方法 知识点题库
①第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生.
②第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出.根据上述实验情况,以下说法错误的是( )
粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:

-
(1) 粉煤灰研磨的目的是.
-
(2) 第1次过滤时滤渣的主要成分有(填化学式,下同)和,第3次过滤时滤渣的成分是
-
(3)
在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与
 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在  相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例).
相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例).
-
(4) 流程中循环使用的物质有和.(填化学式)
-
(5) 用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3•6H2O,该过程能够发生的原因是
-
(6) 用粉煤灰制取含铝化合物的主要意义是.
①容量瓶 ②蒸馏烧瓶③蒸发皿 ④量筒⑤烧杯⑥托盘天平 ⑦分液漏斗 ⑧试管
-
(1) 加热时必须垫石棉网的有.
-
(2) 使用时必须检查是否漏水的是.
-
(3) 标有零刻度的有.
-
(4) 标有使用温度的有.
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2 , 至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;

步骤 3:将滤液真空蒸发浓缩,冷却结晶。
-
(1) 装置 B的烧杯中应加入的溶液是;冷凝管中冷却水从填“a”或“b”)口进水。
-
(2) A 中多孔球泡的作用是。
-
(3) 冷凝管中回流的主要物质除 H2O 外还有(填化学式)。
-
(4) 写出步骤 2 中发生反应的化学方程式。
-
(5) 步骤 3 中在真空容器中蒸发浓缩的原因是。
-
(6) 为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为 。
| 序号 | A | B | C | D |
| 实验目的 | 制取蒸馏水 | 分离水和 植物油 | 分离食盐 水与泥沙 | 从浓食盐水中得到 氯化钠晶体 |
| 分离方法 | 蒸馏 | 分液 | 萃取 | 蒸发 |
| 选用仪器 | | | | |


-
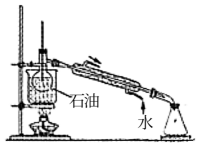
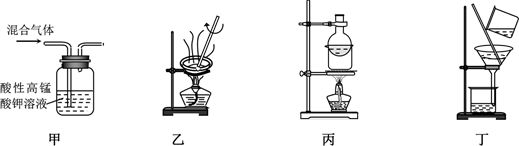
(1) 工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷发生反应:C16H34
 C8H18+甲,甲
C8H18+甲,甲  4乙。则甲的分子式为,乙的结构简式为。
4乙。则甲的分子式为,乙的结构简式为。
-
(2) B装置中的实验现象可能是,写出反应的化学方程式。其反应类型是。
-
(3) C装置中可观察到的现象是,反应类型是。
-
(4) 查阅资料知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置 (填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应。可以测定装置B中溶液在反应前后的酸碱性,简述其理由。
-
(5) 通过上述实验探究。检验甲烷和乙烯的方是 (选填字母,下同):除去甲烷中乙烯的方法是。
A.气体通入水中
B.气体通过盛溴的四氯化碳溶液洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
-
(6) 乙醇分子中不同的化学键如图,查阅资料知,实验室用乙醇和浓硫酸共热至170℃也可以制备乙烯。则反应中乙醇的断键位置为。

| 实验操作 | 结论 | |
| ① | 实验室用电石与饱和食盐水在启普发生器中制乙炔常会闻到臭味 | 乙炔是无色、略有臭味的气体 |
| ② | 在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有沉淀析出 | 溴乙烷在碱性条件下能水解出 |
| ③ | 提纯粗苯甲酸用重结晶法,主要步骤为:加热溶解、趁热过滤、冷却结晶、过滤、洗涤 | 苯甲酸在水中的溶解度受温度影响很大 |
| ④ | 苯不能与酸性高锰酸钾反应,而甲苯却能 | 苯环使甲基活化 |
| ⑤ | 将苯、液溴、铁粉混合物反应产生的气体通入到 | 说明反应为取代反应 |
| ⑥ | 将溴乙烷与 | 不能说明有乙烯生成 |

A.将 | B.向容量瓶内转移溶液 | C.制备氢氧化铁胶体 | D.吸收 |
|
|
|
|
 标准
标准 溶液测定未知浓度的盐酸,其操作步骤如下:
溶液测定未知浓度的盐酸,其操作步骤如下:①将酸式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度或“0”刻度以下位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从酸式滴定管中放出 待测溶液到锥形瓶中。
待测溶液到锥形瓶中。
②将碱式滴定管用蒸馏水洗净后,立即向其中注入 标准
标准 溶液调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
溶液调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗 溶液的体积为
溶液的体积为 。
。
④若按正确操作进行三次实验,其消耗的 溶液的体积见下表:
溶液的体积见下表:
次数 | 1 | 2 | 3 |
体积( | 12.48 | 12.52 | 12.04 |
试回答下列问题:
-
(1) 达到滴定终点时的现象为;该盐酸溶液的浓度为;
-
(2) 该小组在步骤①中的不正确是,由此造成的测定结果(填“偏高”或“偏低”或“无影响”);
选项 | A | B | C | D |
装置 |
|
|
|
|
目的 | 将化学能转化为电能 | 证明非金属性: | 蒸发结晶 | 得到汽油、煤油和柴油等各种馏分 |
 )是一种新型、高效、多功能水处理剂。某化学实验小组模拟工业生产路线,在实验室中制备高铁酸钾,其实验装置如下:
)是一种新型、高效、多功能水处理剂。某化学实验小组模拟工业生产路线,在实验室中制备高铁酸钾,其实验装置如下:

已知: 易溶于水,水溶液为紫色,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
易溶于水,水溶液为紫色,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 , 在0℃~5℃、强碱性溶液中较稳定
, 在0℃~5℃、强碱性溶液中较稳定
-
(1) 仪器a的名称是。
-
(2) 装置A中发生反应的离子方程式为。
-
(3) 装置B中试剂为。
-
(4) 装置C中观察到溶液的颜色变化为,发生主要反应的化学方程式为,加入过量浓KOH溶液的原因是。
-
(5) 有同学提出,装置C在制备
 时存在一定缺陷,改进的措施是。
时存在一定缺陷,改进的措施是。
-
(6) 取C中洗涤并干燥后样品10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为。(计算结果精确到0.1%)
 ,溶液中有淡黄色沉淀生成
,溶液中有淡黄色沉淀生成 的乙醇溶液共热产生的气体通入到酸性
的乙醇溶液共热产生的气体通入到酸性  溶液中,溶液褪色
溶液中,溶液褪色 从溶液中结晶析出
从溶液中结晶析出




 )
)