专题二 从自然资源到化学品 知识点题库
①通足量氯气 ②将海带烧成灰,向灰中加水搅拌
③加CCl4振荡 ④过滤 ⑤用分液漏斗分液。
合理的操作顺序为
海藻  海藻灰
海藻灰  海藻灰悬浊液
海藻灰悬浊液 
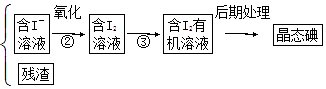
-
(1) 写出提取碘的过程中有关实验操作的名称:①;③.
-
(2) 提取碘的过程中可供选择的有机溶剂是A . 汽油、酒精 B . 四氯化碳、汽油 C . 醋酸、酒精
-
(3) 为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是.
-
(4) 从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图所示的实验装置中的错误之处:①,②,③,④
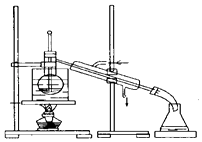
-
(5) 为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在里聚集.

-
(1) 海藻灼烧时是将带其放入(填仪器名称)中,用酒精灯充分加热灰化.
-
(2) 指出提取碘的过程中有关的实验操作名称:①②、.
-
(3) 用CCl4从碘水中提取碘经过操作②后,有机溶剂在(填“上”或“下”)层,有机层呈色.
-
(4) 从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出图2实验装置中的错误之处并改正:
①
②.

提供的试剂:饱和K2CO3溶液、NaOH溶液、Ba(NO3)2溶液、75%的乙醇、生石灰、CCl4、BaCl2溶液
-
(1) 天然水中溶解的气体主要有、.硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).某天然水中c(Ca2+)=1.2×10﹣3mol•L﹣1 , c(Mg2+)=6×10﹣4mol•L﹣1 , 则此水的硬度为.
-
(2) 为除去源水中含有Ca2+、Mg2+、HCO3﹣、Cl﹣、SO42﹣等离子,选出a所代表的试剂,按加入的顺序依次为(只填化学式).
-
(3) 天然水在净化处理过程中加入的混凝剂可以是,其净水作用的原理是.
-
(4) 金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN﹣和金属配离子M(CN)mn的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
Ⅰ.水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收.
Ⅱ.滴定:将吸收液调节至pH>ll.以“试银灵”作指示剂,用AgNO3标准溶液滴定,终点时溶液由黄色变成橙红色,反应的离子方程式为:Ag++2CN﹣═[Ag(CN)2]﹣ .
根据以上知识回答下列问题.①水样预处理的目的是.
②水样预处理的装置如图2所示,细导管插入吸收液中的目的是.
蒸馏瓶比吸收液面要高,其原因是.
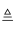 MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
-
(1) (一)以一氯代乙酸钠(CH2ClCOONa)水溶液为原料,通过电解法可以制备1,2-二氯乙烷(CH2ClCH2Cl),装置如图1所示。
所用的离子交换膜是(填“阳”或“阴”)离子交换膜。
-
(2) 写出电解池总反应。
-
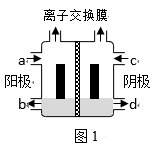
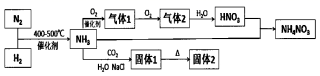
(3) (二)1940年,我国著名化工专家侯德榜先生成功冲破了“索尔维”法的技术封锁,并加以改进,用NaCl固体代替生石灰,加入母液,并联合合成氨厂一起生产出纯碱和氯化铵。这便是举世闻名的“侯氏联合制碱法”,工艺流程如图2。
请回答:
关于合成氨反应,下列说法合理的是___。
A . 反应体系中一般用V2O5作催化剂 B . 因为该反应ΔS小于零,所以反应的ΔH一定也小于零 C . 因为该反应的ΔS小于零,所以反应的压强控制越高越好 D . 该反应往往控制在500℃左右,是因为该温度下反应物转化率最高 -
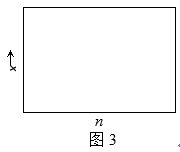
(4) 一定温度下合成氨反应的平衡常数K=48。若在该温度下,在9L的恒容容器中投入1mol氮气和3mol氢气进行反应,则氨气的平衡产率y=;若氮气和氢气的物质的量之比为n∶1,相应平衡体系中氨气的物质的量分数为x,请在图3中绘制x随n变化的示意图(计算时不计副反应)。
-
(5) 侯氏制碱法最大的优点是使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述编号)的循环。
-
(6) 关于侯氏联合制碱法,下列说法合理的是_____。A . 往沉淀池中先通入CO2再通入氨气的目的是提高NaHCO3的产量 B . 往母液中加入食盐的目的是使NaHCO3更多地析出 C . 从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水 D . 往母液中通氨气目的仅仅是增大NH4+的浓度,使NH4Cl更多地析出
 与
与  反应生成
反应生成 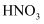 C .
C .  和
和  反应生成
反应生成  D .
D .  和
和  在一定条件下合成氨
在一定条件下合成氨
| 选项 | 化学工业 | 措施 | 目的 |
| A | 合成氨 | 500℃左右 | 防止催化剂中毒 |
| B | 石油化工 | 裂化 | 提高轻质油的产量 |
| C | 工业制硫酸 | V2O5催化 | 提高SO2的转化率 |
| D | 侯氏制碱 | 先通CO2 | 有利于CO2充分吸收 |


-
(1) 步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-41kJ·mol-1
CO2(g)+H2(g)ΔH=-41kJ·mol-1对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是。
a.升高温度 b.减小CO浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若将1molCO和4molH2O的混合气体充入一容积为2L的容器中反应,若第4分钟时达到平衡时放出32.8kJ的能量,则前4分钟的平均反应速率v(CO)为。
-
(2) 步骤Ⅴ的反应原理为N2(g)+3H2(g)
 2NH3(g)ΔH=-92.4kJ·mol-1
2NH3(g)ΔH=-92.4kJ·mol-1 ①合成氨工业采取的下列措施不可用平衡移动原理解释的是(填选项)。
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②450℃时该反应的平衡常数500℃时的平衡常数(填“<”“>”或“=”)。
③合成氨工业中通常采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,理由是。
-
(3) 天然气的主要成分为CH4 , CH4在高温下的分解反应相当复杂,一般情况下温度越高,小分子量的产物就越多,当温度升高至上千度时,CH4就彻底分解为H2和炭黑,反应如下:2CH4
 C+2H2。该反应在初期阶段的速率方程为:r=k×cCH4 , 其中k为反应速率常数。
C+2H2。该反应在初期阶段的速率方程为:r=k×cCH4 , 其中k为反应速率常数。 ①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2=r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大
B.增加氢气浓度,r增大
C.氢气的生成速率逐渐增大
D.降低反应温度,k减小
 分子在催化剂的作用下发生的一系列转化示意图:
分子在催化剂的作用下发生的一系列转化示意图: 
下列叙述正确的是( )
 ,降低温度将缩短反应达到平衡的时间
D . 催化剂
,降低温度将缩短反应达到平衡的时间
D . 催化剂  表面反应生成NO时有电子转移
表面反应生成NO时有电子转移
-
(1) 常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是。(填写序号,下同)
-
(2) 常用于焙制糕点的是;日常生活中常用作消毒的是。
-
(3) 实验室要放在棕色试剂瓶中保存是;除了⑤之外,能与NaOH溶液反应(NaOH参与反应)的是。
-
(4) 在高温条件下金属铝与③发生置换反应的化学方程式为。
反应Ⅰ: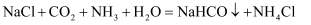
反应Ⅱ: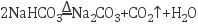
下列制取少量 的实验原理和装置能达到实验目的的是( )
的实验原理和装置能达到实验目的的是( )
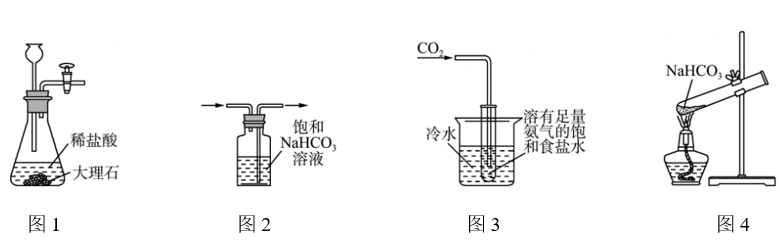
 B . 除去
B . 除去 中
中 C . 制取
C . 制取 D . 制取
D . 制取



