第三单元 硫酸工业 知识点题库
 2SO3中,对“450 ℃”的选择,来自对反应物性质和催化剂性质的综合考虑
2SO3中,对“450 ℃”的选择,来自对反应物性质和催化剂性质的综合考虑
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 .
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体.
①导致溶液温度降低的原因可能是 ;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产.已知该结晶水合物的相对分子质量为134,则其化学式为 ;
③生产中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 .
(3)能用于测定硫酸尾气中SO2含量的是 .(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.水、淀粉溶液
D.氨水、酚酞试液.
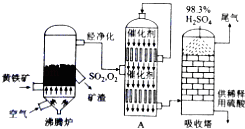
以黄铁矿为原料生产硫酸的工艺流程图如下:
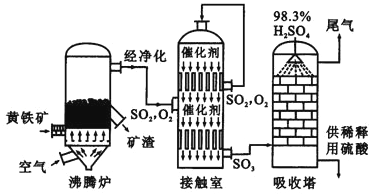
(1)将燃烧黄铁矿的化学方程式补充完整:4 +11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 .
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) .
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是 .
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2 . SO2吸收Br2的离子方程式是 .
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变.计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 .(计算结果保留两位小数)
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2 , 反应的化学方程式为: ,该反应在 (填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是 .
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2 , 再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 .
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 .
| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可): 、 .
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2 , 通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的 %.

-
(1) 以黄铁矿为原料生产SO2时反应的化学方程式为:,该反应在中进行(填设备名称);
-
(2) 某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是;
压强(Pa)
温度(℃)
1.013×105
5.065×105
10.13×105
15.195×105
400
99.61%
99.72%
99.84%
99.88×105
500
96.75%
97.67%
98.52%
98.94%
600
85.20%
88.97%
92.76%
94.68%
-
(3) 接触室内有一热交换器,其作用是,若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式);
-
(4) 下列做法中,与提高硫酸工业的经济效益无关的是;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
-
(5) 硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)、;
②将尾气中SO2在一定条件下转化为CaSO4 , 然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式;
-
(6) 若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为.
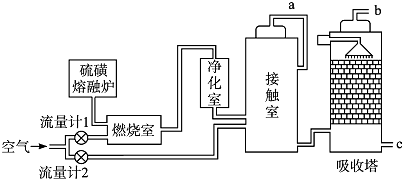
请回答下列问题:
-
(1) 为充分利用反应放出的热量,接触室中应安装(填设备名称);吸收塔中填充有许多瓷管,其作用是;吸收塔不用水而用98.3%浓硫酸吸收SO3的原因是.
-
(2) 硫酸的用途非常广泛,可应用于下列哪些方面.
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.制备大量硫磺
-
(3) 硫酸的各个生产环节中都有一些废渣、废液、废气产生,需要进行治理.由吸收塔排出的尾气中SO2的含量若超过500 μL•L﹣1 , 就要加以处理处理才能排出.处理方法之一是用氨水洗涤烟气脱硫,所得产物可作为肥料.请写出此脱硫过程中可能发生的化学方程式:.
-
(4) 用含硫量为a%硫矿制硫酸,若燃烧时损失b%的硫元素,由SO2制SO3的转化率为c%.则制取1吨98%的硫酸需这种硫矿吨(用代数式表达)
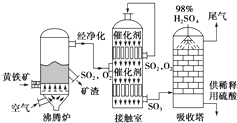
-
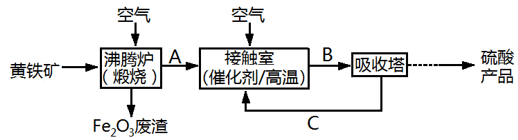
(1) 沸腾炉中发生的反应方程式为.
-
(2) 接触室中发生反应的化学方程式是、
-
(3) 依据工艺流程图判断下列说法正确的是(填字母).
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
-
(4) 吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2 . SO2吸收Br2的离子方程式是.
-
(1) 硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为.
-
(2) 流程图中设备A是(填设备名称),其中该设备上部迅婚使用的气体为.
-
(3) 吸收塔采用98.3%浓硫酸吸收SO2的原因是.
-
(4) 根据工艺流程图及环保角度判断下列说法正确的是 (填序号)A . 为使黄铁矿充分燃烧,需将其粉碎 B . 沸腾炉中排出的炉渣可供炼铁 C . 使用催化剂可提高SO2的反应速率和转化率 D . 尾气中SO2可用NaOH浓溶液来吸收 E . 硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
-
(5) 沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
600
620
640
660
炉渣中CuSO4的质量分数/%
9.3
9.2
9.0
8.4
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因.
-
(6) 某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为.
 在空气中加热可得固体
在空气中加热可得固体  B .
B .  加入到过量
加入到过量  溶液中可得
溶液中可得  C .
C .  在沸腾炉中与
在沸腾炉中与  反应主要生成
反应主要生成  D .
D .  溶液中加入少量
溶液中加入少量  粉末生成
粉末生成  和
和 
4FeS2 + 11O2 → 2Fe2O3 + 8SO2。
完成下列填空:
-
(1) 煅烧黄铁矿在(填设备名称)中进行,此反应中被氧化的元素是。
-
(2) SO2的催化氧化:2SO2(g)+O2(g)
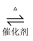 2SO3(g),该反应的平衡常数表达式为K= ;反应达到平衡,及时分离出SO3 , 则平衡向方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为反应(选填“吸热”“放热”)。
2SO3(g),该反应的平衡常数表达式为K= ;反应达到平衡,及时分离出SO3 , 则平衡向方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为反应(选填“吸热”“放热”)。
-
(3) 下图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是(选填编号)。

a. 增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
改变条件后,平衡混合物中SO3的百分含量(选填“增大”“减小”“不变”)。
-
(4) SO3的吸收:SO3 + H2O → H2SO4 。假定制备硫酸的整个过程中S元素共损失10%,则含1000 kg FeS2的黄铁矿可以制得98%的浓硫酸kg。
回答下列问题:
-
(1) 在接触室中发生的反应是2SO2+O2
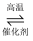 2SO3 , 该反应属于(填字母)
2SO3 , 该反应属于(填字母) a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
-
(2) 写出Cu和浓硫酸反应的化学方程式。
-
(3) 写出沸腾炉中发生反应的化学方程式:
-
(4) 取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是。
-
(5) SO2可用于杀菌、消毒。葡萄酒里含有微量SO2 , 起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的还原性。氯水和SO2都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:。




