第三单元 共价键 原子晶体 知识点题库
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ•mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
-
(1) 已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):SiCSi,SiSiO2
-
(2) 工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),
Si(s)+4HCl(g),则2mol H2生成高纯硅需(填“吸收”或“放出”)能量kJ.
下列说法中正确的是( )
A . 分子中键能越大,键越长,则分子越稳定
B . 失电子难的原子获得电子的能力一定强
C . 在化学反应中,某元素由化合态变为游离态,该元素被还原
D . 电子层结构相同的不同离子,其半径随核电荷数增多而减小
下列过程中,共价键被破坏的是( )
A . HCl气体溶于水
B . 溴蒸气被木炭吸附
C . 酒精溶于水
D . 碘升华
下列叙述中正确的是( )
A . 共价化合物中原子都一定满足最外层8电子结构
B . 通过共价键形成的分子一定是共价化合物
C . 共价化合物中可能含有离子键
D . 微粒间通过共价键形成的晶体,具有较高的熔、沸点
下列物质中,只有共价键的是( )
A . Ca(NO3)2
B . KOH
C . H2O
D . NH4F
在共价化合物中,元素化合价有正负的主要原因是( )
A . 电子有得失
B . 共用电子对有偏移
C . 电子既有得失又有电子对偏移
D . 有金属元素的存在
氰气的分子式为(CN)2 , 结构式为N 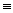 C-C
C-C 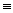 N,性质与卤素相似,下列叙述正确的是( )
N,性质与卤素相似,下列叙述正确的是( )
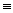 C-C
C-C 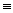 N,性质与卤素相似,下列叙述正确的是( )
N,性质与卤素相似,下列叙述正确的是( )
A . 分子中四原子共直线,是非极性分子
B . N 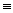 C 键的键长大于C
C 键的键长大于C 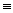 C键的键长
C . 分子中含有2个σ键和4个π键
D . 氰气不和氢氧化钠溶液发生反应
C键的键长
C . 分子中含有2个σ键和4个π键
D . 氰气不和氢氧化钠溶液发生反应
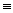 C 键的键长大于C
C 键的键长大于C 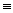 C键的键长
C . 分子中含有2个σ键和4个π键
D . 氰气不和氢氧化钠溶液发生反应
C键的键长
C . 分子中含有2个σ键和4个π键
D . 氰气不和氢氧化钠溶液发生反应
能够用键能解释的是( )
A . 氮气的化学性质比氧气稳定
B . 常温常压下,溴呈液体,碘为固体
C . 稀有气体一般很难发生化学反应
D . 硝酸易挥发,硫酸难挥发
下列观点正确的是( )
A . 化合物电离时,生成的阴离子是氢氧根离子的是碱
B . 某化合物的熔融状态能导电,该化合物中一定有离子键
C . 某化合物的水溶液能导电,该化合物可能是非电解质
D . 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
原子晶体具有的性质是()
A . 熔点高
B . 易导热
C . 能导电
D . 有延展性
下列说法错误的是()
A . 分子式为C5H10O2的羧酸共有3种
B . 分子式为C3H9N的异构体共有4个
C . 某烷烃CnH2n+2的一个分予中,含有共价键的数目是3n+1
D . 某烷烃CnH2n+2的一个分子中,含有非极性键的数目是n-1
NH3 分子的空间构型是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是( )
A . NH3分子是极性分子
B . 分子内3个N—H键的键长相等,键角相等
C . NH3分子内3个N—H键的键长相等,3个键角都等于107°
D . NH3分子内3个N—H键的键长相等,3个键角都等于120°
下列说法中正确的是( )。
A . 分子之间存在化学键
B . 所有物质中都含有化学键
C . 一个分子中不可能既有极性键又有非极性键
D . 离子化合物中可能含非极性共价键
下列叙述正确的是( )
A . 离子化合物中不可能含共价键
B . 活泼金属与活泼非金属化合时能形成离子键
C . 由非金属元素形成的化合物一定是共价化合物
D . 共价化合物不可能含有离子键,熔融状态可以导电
下列叙述正确的是( )
A . 电负性:S>Cl
B . 键角:NH3<H2O
C . 中心原子杂化轨道数:  D . 键长:HF<HCl
D . 键长:HF<HCl
 D . 键长:HF<HCl
D . 键长:HF<HCl
-
(1) Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为。
-
(2) NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为,键角由大到小的顺序为。
-
(3) 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol 该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。

某化合物结构如图所示。其中X、Y、W、Z是原子序数依次增大的短周期主族元素,W的最外层电子数是Y的最外层电子数的2倍,Z和X同主族。下列说法错误的是( )

A . 原子半径:Z>Y>W>X
B . W与Z形成的化合物中可能既有离子键,又有共价键
C . 该化合物中除X原子外,其它原子都满足8电子稳定结构
D . Y的最高价氧化物对应水化物是一种弱酸
绿芦笋中含有天门冬氨酸(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。回答下列问题:

-
(1) 天门冬氨酸中C、N、O三种元素的第一电离能由大到小的顺序是,电负性最大的元素的价层电子轨道表示式。铬元素位于周期表第周期族,其基态原子的电子排布式为。
-
(2) 天门冬氨酸中的共价键类型为(填“σ键”、“π键”),其中N原子的杂化轨道类型为,图中O-C-C的键角-C-C-N的键角(填“大于”或“小于”)。
-
(3) H2S和H2Se热稳定性较好的是,从分子结构角度解释其原因:。
-
(4) 分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH2 , 换成—NO2 , 得到的新物质的酸性会增强,原因是。
-
(5) 四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点变化的是曲线(填字母),用分子间作用力解释该曲线:。O—H…O的键能小于F—H…F,但水的沸点高于HF的原因可能是。

某些氢键的键能和键长
氢键X—H…Y
键能/(kJ·mol-1)
键长/pm
代表性例子
F—H…F
28.1
255
(HF)n
O—H…O
18.8
276
冰
O—H…O
25.9
266
甲醇,乙醇
N—H…F
20.9
268
NH4F
N—H…O
20.9
286
CH3CONH2
N—H…N
5.4
338
NH3
煤和石油是重要的能源物质,一方面对其开发利用推动人类社会快速进入工业文明时代,另一方面化石燃料燃烧产生 带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:
带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:
 带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:
带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:


 等产物在化工生产中都有广泛用途。下列有关
等产物在化工生产中都有广泛用途。下列有关 的说法正确的是( )
的说法正确的是( )
A .  中
中 的键角比
的键角比 中的大
B .
中的大
B .  的水溶液不能导电
C .
的水溶液不能导电
C .  的空间构型为平面正三角形
D .
的空间构型为平面正三角形
D .  和
和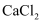 形成的
形成的 中有6个配位键
中有6个配位键
 中
中 的键角比
的键角比 中的大
B .
中的大
B .  的水溶液不能导电
C .
的水溶液不能导电
C .  的空间构型为平面正三角形
D .
的空间构型为平面正三角形
D .  和
和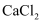 形成的
形成的 中有6个配位键
中有6个配位键
[选修3:物质结构与性质]
铁和硒(  )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
-
(1) 乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①基态
 原子的核外电子排布式为
原子的核外电子排布式为  ;
;②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态
 分子
分子  离子(填“>”“<”或“=”),原因是。
离子(填“>”“<”或“=”),原因是。 -
(2) 富马酸亚铁
 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:

①富马酸分子中
 键与
键与  键的数目比为;
键的数目比为;②富马酸亚铁中各元素的电负性由大到小的顺序为。
-
(3) 科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将  转化为
转化为  ,反应过程如图所示:
,反应过程如图所示:

①产物中N原子的杂化轨道类型为;
②与
 互为等电子体的一种分子为(填化学式)。
互为等电子体的一种分子为(填化学式)。 -
(4) 钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为;
②
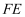 原子的配位数为;
原子的配位数为;③该晶胞参数
 、
、  。阿伏加德罗常数的值为
。阿伏加德罗常数的值为  ,则该晶体的密度为
,则该晶体的密度为 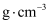 (列出计算式)。
(列出计算式)。
最近更新



